Некоторые проблемы биотехнологии выращивания личинок гигантской пресноводной креветки MACROBRACHIUM ROSENBERGII (DECAPODA: PALAEMONIDAE)
Работы по культивированию гигантской пресноводной креветки Macrobrachium rosenbergii (De Man, 1879) в Крыму проводятся с 2000 г. К настоящему времени отработана и успешно применяется технология полного цикла выращивания данного вида — от подготовки и содержания маточного стада производителей до получения посадочного материала и товарной продукции.
Однако, несмотря на сравнительно большое число исследований в этом направлении и значительное количество предложений по совершенствованию данного биотехнологического процесса, смертность креветок на всех этапах развития продолжает оставаться высокой. Важную роль в снижении численности личинок креветки играют болезни, хищники-планктофаги и низкое качество воды (Хмелева и др., 1997; Сальников, Суханова, 2000).
Настоящая работа посвящена исследованию некоторых проблем искусственного воспроизводства гигантской креветки в условиях питомника на наиболее сложном этапе её онтогенеза — личиночном развитии.
Материалы и методы Исследования проводили в период с 2001 по 2013 г. в экспериментальном креветочном комплексе на базе Научно-исследовательского центра «Государственный океанариум» (г. Севастополь).
Материалом для изучения послужили личинки, полученные в результате нереста самок гигантской креветки. Личинок содержали в инкубаторах, каждый объемом 300 л, при постоянной температуре (31 оC) и аэрации. Для аэрации воды использовали компрессоры Resun ACO–006 (88 л/мин). Определение растворенного в воде кислорода проводили по методу Винклера (Лурье, 1971).
В ходе экспериментальных работ воду с необходимой для выращивания личинок соленостью (12 ‰) получали путем разбавления черноморской воды обычной водопроводной, которую предварительно отстаивали и обеззараживали с помощью ультрафиолетовой установки UV 12 GPM (производительность 2,5 м3/ч). Соленость воды определяли с помощью ареометра с точностью 0,0001. В качестве корма для личинок использовали однодневные науплии артемии.
В инкубаторах осуществляли постоянную фильтрацию воды с помощью внешнего фильтра Eheim Classic 2215 (620 л/ч), для каждого аппарата использовался отдельный фильтр. Исследования динамики численности гидромедузы проводили в период с 2001 по 2003 г. на базе отдела физиологии животных и биохимии Института биологии южных морей. Пробы отбирали ежемесячно в прибрежной зоне Севастополя на 11 станциях от траверза бухты Омега до кута Севастопольской бухты. Пробы собирали сетью Джеди (площадь облова 0,1 м2, размер ячеи 112 мкм). Обработка проб проводилась в лабораторных условиях. Подсчет особей осуществляли с помощью бинокуляра в камере Богорова.
Результаты и их обсуждение Газо-пузырьковая болезнь (газовая эмболия). В декабре 2012 г. в условиях креветочного комплекса была зафиксирована гибель личинок в результате газо-пузырьковой болезни, вызванной содержанием креветок в воде с повышенной аэрацией. Сверхактивная аэрация привела к перенасыщению воды кислородом, содержание которого достигало 160 % и более, при оптимальном — 70 % (Сальников, Суханова, 2000). При газовой эмболии многочисленные пузырьки газа скапливаются под карапаксом личинок, травмируя ткани их внутренних органов, что и приводит в конечном итоге к летальному исходу. Массовая гибель личинок отмечается в течение нескольких часов. Для предупреждения возникновения заболевания необходимо поддерживать параметры среды на оптимальном уровне.
Недостаток кислорода в инкубаторах. Высокую смертность личинок вызывает также и низкий уровень растворенного в воде кислорода — менее 1 мг/л (при оптимальном — 5 мг/л) (Найденова, 2003). В условиях питомника причиной снижения уровня кислорода в инкубаторах, где содержали личинок, было аварийное отключение электричества более чем на 2 ч.
При дефиците кислорода личинки креветки скапливаются в поверхностном слое воды. Пораженные особи вялые, плохо поедают корм. Признаком тканевой гипоксии является диффузная непрозрачность абдоминальной мускулатуры.
Для исключения возможности потери креветок в результате сбоев поставки электроэнергии питомник должен быть оснащен автономным источником бесперебойного питания.
Заражение инкубаторов гидромедузой Sarsia tubulosa. В ходе проводимых нами экспериментов при культивировании личинок креветки в контролируемых условиях питомника с использованием черноморской воды мы столкнулись с такой проблемой, как заражение инкубаторов гидромедузой Sarsia tubulosa. Впервые данный факт был отмечен в 2001 г.
Гидромедуза S. tubulosa (M. Sars, 1835) относится к типу кишечнополостных Coelenterata, классу Hidrozoa, отряду Leptolida, семейству Corynidae, роду Sarsia (WoRMS). В жизненном цикле гидромедузы, как и у многих других кишечнополостных, происходит чередование двух поколений: сидячего колониального полиповидного, размножающегося вегетативно (почкованием или делением), и медузоидного, особи которого не образуют колоний и размножаются половым путем.
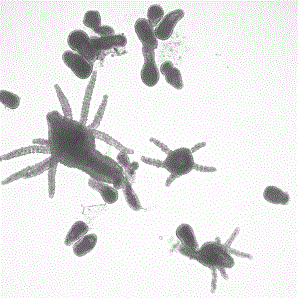
Колонии полипов стелющиеся или слабо разветвленные, высотой 2–3 см. Тело отдельного полипа достигает 1–2 мм в высоту. Полип имеет беспорядочно расположенные головчатые щупальца (Brinckmann-Voss, 2000). Под щупальцами развиваются медузоидные почки, которые отделяются от тела полипа, превращаясь в гидромедуз (рис. 1).
Рис. 1. Полип гидромедузы Sarsia tubulosa, видны медузоидные почки и медузы (фото З.А. Романовой)
Размер только что отпочковавшихся медуз составляет 0,15 мм. Максимальные размеры медуз в Черном море 8–10 мм (Наумов, 1968). Внешне гидромедуза напоминает прозрачный зонтик или колокол, внутри которого находятся 4 радиально расположенных канала и отходящий от места их скрещивания ротовой хоботок. По краю зонтика у медуз расположены 4 очень длинных щупальца с глазками у основания (рис. 2).
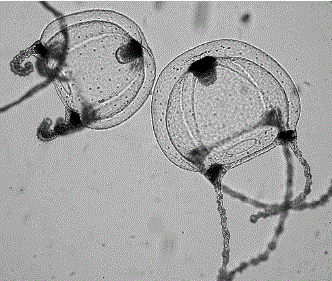
Рис. 2. Свободно плавающие особи гидромедузы Sarsia tubulosa (размеры купола 0,5 мм) (фото З.А. Романовой)
Медузы раздельнополы, половые продукты они выметывают в воду, где и происходит оплодотворение яиц, из которых возникает личинка — планула (рис. 3).
Рис. 3. Планулы гидромедузы Sarsia tubulosa и прорастание их в полип (фото З.А. Романовой)
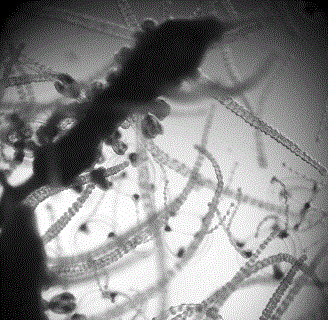
Планулы этого вида медуз очень мелкие и достигают в длину 0,20 мм, в ширину 0,05–0,08 мм (Наумов, 1968). При заполнении инкубаторов для получения и содержания личинок креветки черноморской водой ее предварительно фильтровали через сито с ячеей 112 мкм или 0,1 мм. Очевидно, что планулы медуз, ширина которых колебалась в пределах 56–90 мкм, легко проходили через такое сито. Попав в благоприятные условия, они переходили в стадию полипов, которые росли со значительной скоростью. Когда полип достигает полной зрелости, от него почкованием отрываются молодые медузы, которые свободно плавают и вновь откладывают яйца. Этот процесс беспрерывен. Когда гидромедуза попадает в аппарат для выращивания личинок, она поселяется всюду: на стенках и стыках инкубатора, внутри биофильтров, на кислородном шланге и распылителе и т.д. (рис. 4). Достаточно одной планулы, чтобы возродить гидромедузу вновь.
Рис. 4. Заражение инкубаторов для содержания личинок гидромедузой Sarsia tubulosa (фото автора)
Для S. tubulosa, как и для всех кишечнополостных, характерной особенностью является наличие в их теле особых стрекательных, или крапивных, клеток. Каждая стрекательная клетка содержит хитиноидную капсулу (ее полость заполнена ядовитой жидкостью), которая состоит из пузырька и длинной, снабженной шипами нити (стрекательная нить). При «выстреле» этой капсулы нить вонзается в тело жертвы, а через ее полость изливается яд, вызывающий паралич и смерть (Brinckmann-Voss, 2000). После этого жертва переносится щупальцами к ротовому отверстию и проглатывается. Даже довольно крупные животные часто оказываются пораженными ядом стрекательных капсул.
Стрекательные клетки располагаются по всей поверхности тела гидромедузы, но их наибольшие скопления отмечаются на щупальцах и вокруг ротового отверстия. После «выстрела» стрекательная клетка погибает и на ее месте или поблизости от него развивается новая.
В Черном море S. tubulosa обычный, часто встречающийся вид. Полипы поселяются на литорали, медузы держатся в поверхностных слоях воды, вблизи берегов. Этот вид широко распространен в арктических и бореальных водах северного полушария (Наумов, 1968).
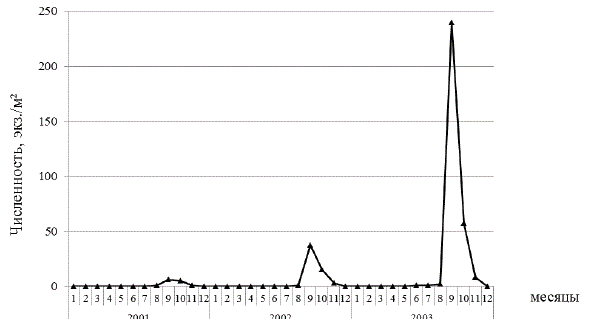
Массовая вспышка численности гидромедузы в аппаратах для выращивания личинок гигантской креветки нами была отмечена в осенне-зимние месяцы (октябрь-декабрь). Анализ численности гидромедузы S. tubulosa в период с 2001 по 2003 г. в прибрежной зоне Севастополя показал, что этот вид присутствует в планктоне в основном в осенний период. Ее массовое размножение приходится на сентябрь-октябрь, о чем свидетельствуют пики численности именно в этот период, при этом численность гидромедузы увеличивалась от 6 экз./м2 в сентябре 2001 г. до 240 экз./м2 в сентябре 2003 г. (рис. 5). В октябре 2002 г. численность гидромедуз составляла 37 экз./м2.
Рис. 5. Динамика численности гидромедузы в прибрежных водах Севастополя в период 2001–2003 гг.
В аппаратах легкой добычей для гидромедузы стали личинки гигантской креветки и науплии Artemia salina (Linnaeus, 1758), которые использовались в качестве корма для креветок. Этот факт подтверждают результаты проведенного анализа содержимого кишечной (гастральной) полости гидромедузы, удаленной из инкубатора. При анализе полипа, извлеченного из инкубационного аппарата, установлено, что его пищеварительный тракт забит личинками креветки и науплиями артемии. В результате питания рачками A. salina колонии полипов гидромедузы приобретали розоватый цвет.
Присутствие гидромедузы S. tubulosa в системе культивирования личинок гигантской креветки существенно снижает их выживаемость. В наших условиях при оптимальных параметрах среды выращивания (при условии отсутствия гидромедузы) выживаемость личинок в среднем составляет 56 %, тогда как при тех же условиях содержания, но при наличии гидромедузы в инкубаторах выживаемость личинок в среднем составляет 27 %. Таким образом, наличие в инкубаторах гидромедузы S. tubulosa в два раза снижает количество получаемой постличинки креветки.
Опыт показывает, что при попадании гидромедузы в инкубаторы для выращивания личинок креветки все методы борьбы с ней бесполезны, поскольку они оказывают негативное воздействие и на личинок креветки. В данном случае основная задача состоит в том, чтобы не допустить попадания гидромедузы в систему культивирования.
Единственным способом решения поставленной задачи является фильтрация морской воды при наборе в аппараты через сито с ячеей не более 20 мкм.
Асинхронность линек. Для гигантской креветки характерно 11 стадий личиночного развития, каждая из стадий проходит за 1–4 суток. Однако, как установлено в ходе эксперимента, не все личинки линяют одновременно (см. таблицу).
Продолжительность развития личинок гигантской креветки Duration of larval development for giant prawn
Примечание. Pl — Postlarvae (постличинка).
Наибольшая неравномерность линек у креветок наблюдается на 13–19-е сутки, т.е. на последних стадиях развития, перед метаморфозом личинки в постличинку. Такая несинхронность линек усиливает каннибализм у креветок и, как следствие, снижает их выживаемость на данном этапе развития. Этот факт отмечен и другими авторами (Ковачева, 2008). Многие исследователи сходятся во мнении, что для повышения выживаемости гидробионтов необходимо синхронизировать процесс линьки у личинок в условиях аквакультуры (New, Valenti, 2000; Coyle et al., 2003), чего можно достичь путем полного контроля и управления условиями содержания креветок: температурой и соленостью воды, содержанием растворенного в ней кислорода, азотных соединений, кормовых организмов на единицу объема на всех стадиях выращивания.
Выводы Результаты многолетних исследований показали, что снижение численности личинок гигантской креветки в условиях искусственного выращивания происходит в большей степени за счет несоблюдения биотехнологических норм культивирования и, как следствие, развития заболеваний различной этиологии, которые наносят значительный ущерб креветочным хозяйствам.
Успешное выращивание гигантской креветки во многом зависит от соблюдения оптимальных параметров среды содержания, недопущения проникновения в инкубаторы опасных гидробионтов, использования доброкачественной и сбалансированной по витаминному и аминокислотному составу пищи, аккуратного обращения с креветками при проведении различных технических мероприятий с целью предупреждения возникновения у них травм. Соблюдение всех вышеперечисленных мероприятий позволит повысить выживаемость гидробионтов, что положительно отразится на урожайности гигантской креветки.
Статкевич Светлана Вячеславовна, младший научный сотрудник, e-mail: statkevich. Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра..
Институт морских биологических исследований им. А.О. Ковалевского РАН, 299011, г. Севастополь, просп. Нахимова, 2