Разработка биотехнологии культивирования морских и солоноватоводных инфузорий
В современный период остается актуальной проблема совершенствования технологической схемы культивирования мелких беспозвоночных как стартового корма для выращивания личинок и молоди рыб, которая с переходом рыбоводства на индустриальные методы выращивания не теряет своей значимости, поскольку естественный зоопланктон является обязательным в рационе личинок пресноводных и морских рыб, особенно в период раннего развития [9, 16, 22].
Инфузории – это простейшие организмы (тип – Ciliophora), тело которых морфологически соответствует одной клетке, будучи вместе с тем самостоятельным организмом со всеми присущими организму функциями. Важным систематическим признаком инфузорий служат реснички, присутствующие обычно в большом количестве в течение всего жизненного цикла (класс – Ciliata) или лишь на определенных его этапах (класс – Sustoria). Вторым важным общим признаком инфузорий является присутствие в их теле по меньшей мере двух качественно различных ядер [5, 6, 23]. В настоящее время существуют методы промышленного разведения пресноводных инфузорий.
При их выращивании используют следующие методы: периодическое культивирование (или полунепрерывное) и накопительное. Первое используют обычно при описании массового культивирования с периодическим удалением прироста инфузорий, сменой среды и добавлением корма при несовпадающей периодичности этих процессов, а также при описании массового культивирования с периодической заменой части объема культуры свежей культуральной средой. Под накопительным культивированием обычно понимают выращивание инфузорий в непроточном объеме при постоянном внесении корма до момента достижения максимальной численности, биомассы или прироста этих показателей [10, 12].
В практике лабораторного и массового культивирования обычно используют высокопродуктивные и широко распространенные в эвтрофных пресноводных водах виды, такие как Paramaecium caudatum, P. aurelia, P. bursaria, P. multimicronudeatum, Stylonychia (Oxytricha) pastulata, Colpoda steine, Colpidium colpoda, C. stiatum, C. campilium, Tetrahymena pyriformis. Применение различных методов выращивания инфузорий обеспечивает непрерывный рост и довольно высокую продуктивность культуры (до 500 мг/м3 сырой биомассы ежесуточно) [4, 10, 16, 18, 28, 29].
Исследователи указывают, что вследствие своей высокой продуктивности, способности к поглощению различных химических и биологических веществ не только ртом, но и всей поверхностью тела питательную ценность инфузорий можно легко изменять, применяя при выращивании различные ингредиенты. Состав пищи, в свою очередь, влияет на время генерации инфузорий [1, 5, 14, 15, 24]. Морские инфузории, как и пресноводные, обладают высокой скоростью размножения, часто используются как объекты биотестирования загрязненных морских вод. Кроме того, планктонные инфузории являются важнейшим звеном в гетеротрофных цепях водоемов и принимают активное участие в процессах трансформации органического вещества, обладая при этом высокими продукционными возможностями. Их доля в суммарной биомассе зоопланктонного сообщества в морях и океанах составляет от 5 до 10 % [11, 25].
Попытки промышленного способа выращивания морских простейших начались за рубежом с 70-х гг. XX века. Культивируемыми видами являлись ресничные инфузории родов: Euplotes, Favella, Tintinopsis, Fabres [26]. Имеются также работы об использовании инфузорий как стартового корма для личинок морских рыб [7, 13, 19, 26]. Методы содержания и выращивания морских инфузорий опираются на микробиологические методические разработки по культивированию простейших [2, 3, 10, 27].
В практике разведения инфузорий для их кормления используют: сенной настой, кормовые и пекарские дрожжи, микроводоросли и различные питательные добавки в виде солей химических веществ, полисахариды, аминокислоты, витамины, ферменты. При выращивании инфузорий учитываются также такие параметры среды: содержание кислорода (оптимум – 4-8 мг/л); водородный показатель рН – 7,6-8,5; температура – 20-28 °С; продукты метаболизма следует удалять, регулировать количество и качество корма [1, 10, 18].
Нельзя сказать, что массовое культивирование морских инфузорий было малоуспешным, но в литературе не встречается описания эффективных способов выращивания морских простейших.
Поэтому тема получения биотехнологии культивирования морских инфузорий остается актуальной. Целью исследований было разработать биотехнологию промышленного культивирования инфузорий, применяя в качестве корма для простейших питательные смеси на основе удобрений, химических солей, витаминов и др. ингредиентов.
По мере проведения работ были поставлены следующие задачи:
1. Провести исследования основных параметров выращивания инфузорий (удельная продукция, время генерации, число делений в сутки – р. Euplotes и р. Mesodinium при неблагоприятном температурном режиме (10-14 °С).
2. Исследовать влияние питательных смесей различного состава и кормовых дрожжей на динамику численности инфузорий при неоптимальном режиме температуры.
МАТЕРИАЛЫ И МЕТОДИКА
Научно-исследовательские работы по массовому культивированию инфузорий проводились на экспериментальной базе ЮгНИРО – НИБ «Заветное» (Керченский пролив) в период с 1985 по 2014 г. и в Одесской области на Шаболатском лимане (база ХТМО) в 2008 г.
Материалом для исследований служили 4 вида инфузорий: Euplotes affinis Dujardin 1842; E. charon O.F. Müller, 1786; Mesodinium pulex Claparede et Lachmann, 1858; Metacylis mediterranea var. longa Brandt, 1908. Культуры организмов выделялись из солоноватоводных водоемов, расположенны вдоль побережья Керченского пролива, и Черного моря. Маточные культуры зоопланктеров отбирались с помощью гидробиологических сачков из газ-мельничного сита № 77.
Для культивирования использовались различные емкости: стандартные рыбоводные лотки (4,5 0,68 0,45 м), стеклопластиковые емкости объемом от 100 л до 2 м3. Все емкости перед заселением гидробионтов обрабатывались раствором фуразолидона (0,5 мг/л). Выращивание производилось под навесом и на открытом пространстве в условиях окружающей среды. Емкости для культивирования имели естественное освещение днем и искусственное ночью – галогеновыми и люминесцентными лампами мощностью до 300 ватт.
Сбор зоопланктона и камеральную обработку проб проводили по стандартным методикам [17, 21]. Для поддержания кислородного режима в емкостях применялись аквариумные и стационарные компрессоры и пластиковые распылители. Барботаж культуральной среды сжатым воздухом в бассейнах и лотках осуществлялся круглосуточно, каждые 5-7 суток проводилась замена 1/3 части культуральной среды на свежую морскую воду и частичная чистка дна емкостей.
Зоопланктон культивировался накопительными (культивирование партиями) и полунепрерывными способами. В зависимости от концентрации инфузорий в пробе производилось разбавление пробы профильтрованной водой соответствующей солености в 2-50 раз. Для определения видовой принадлежности инфузории окрашивались 0,1-0,5 % водным раствором азотнокислого серебра (AgNO3), либо раствором Люголя (0,5 г кристаллического йода и 0,5 г йодида калия в 100 мл воды), либо слабокислым раствором Конго красного (рН = 5,2).
Эксперименты по определению удельной продукции и времени генерации инфузорий проводились в часовых стеклах, куда помещали одну инфузорию сразу после деления. Вода для опыта профильтровывалась через фарфоровые воронки с микропорами до 5 мкм. Кормом служила питательная смесь, которая вносилась на кончике препаровальной иглы или микробиологическими пипетками объемом 10 μl .
Продолжительность опытов составила 36 часов, опыты проведены в трех повторностях. Температура добавляемой воды соответствовала температуре, при которой проводилось массовое культивирование инфузорий. Расчеты удельной продукции и времени генераций велись по формулам, приведенным В.Е. Заикой [8].
Таблица 1
Нормы и периодичность внесения ингредиентов (на 1 м3) для культивирования инфузорий
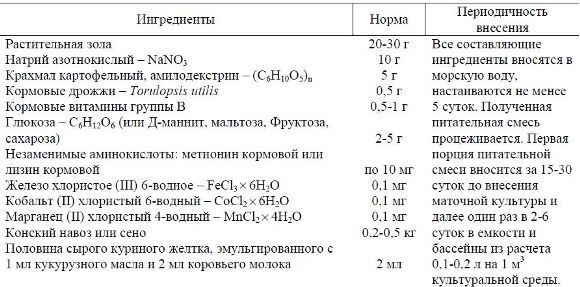
Примечание 1. По достижении температуры культуральной среды выше 20 °С нормативы внесения ингредиентов рекомендуется уменьшить в 2 раза.
Примечание 2. По достижении численности инфузорий более 100 млн. экз./л нормативы внесения ингредиентов рекомендуется увеличить в 2 раза.
На дно бассейнов вносились кораллово-ракушечные фракции в количестве 5-7 кг/м2. Плотность маточной культуры составляла: у E. Affinis – 3-4 экз./мл, у E. charon и M. pulex – 1-2 экз./мл, у M. mediterranea – 0,01 экз./мл.
В табл. 1 приводятся нормы и периодичность внесения ингредиентов для приготовления питательных смесей при культивировании инфузорий на 1 м3 культуральной среды.
В табл. 2 приводятся рекомендуемые интервалы средних гидрохимических показателей при массовом выращивании инфузорий.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
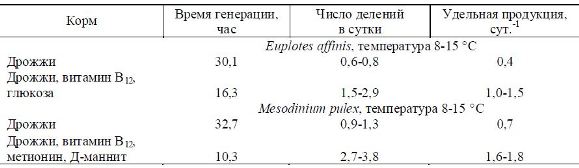
Полученные усредненные результаты по величине удельной продукции и скорости размножения в зависимости от состава вносимого корма приводятся в табл. 3.
По представленной табл. 3 видно, что скорость размножения и удельная продукция в опыте, где кормом являлись дрожжи в смеси с витаминами, почти в два раза больше, чем в контрольном, где кормом служили «чистые» дрожжи.
Сравнительно высокие значения удельной продукции, полученные в опытах с добавлением витаминов, полисахаридов, аминокислот, по-видимому, объясняются тем, что эти ингредиенты способствуют более ускоренному темпу деления инфузорий. Эти результаты согласуются с данными других авторов, которые отмечают, что применение цианкоболамина при выращивании инфузорий позволяет уже в течение первых двух суток получать высокую численность бактерий (50-60 тыс. экз./мл). Инфузории интенсивно потребляют полисахариды (сахарозу, мальтозу, лактозу), которые хорошо усваиваются и перерабатываются с помощью специальных энзимов [5, 27, 23].
В описанном выше исследовании автор получила при температуре 10-14 °С удельную продукцию для p. Euplotes (с = 1 сут.-1) и p. Mesodinium (с = 1,6 сут.-1), а максимальное значение удельной продукции для инфузорий, близких к изученным автором размерным группам, по данным других авторов, равно 0,4-2,8 сут.-1 при температуре 23-25 °С [8]. Следовательно, можно предположить, что
Таблица 2

Таблица 3
Скорость размножения и удельная продукция инфузорий в зависимости от состава вносимого корма
Средние гидрохимические показатели водной среды, рекомендуемые для массового культивирования морских инфузорий применяемые питательные смеси для культивирования инфузорий позволяют получать продукцию даже при неоптимальном режиме температуры.
Следующей задачей при культивировании инфузорий было исследование влияния питательных смесей различного состава и кормовых дрожжей на динамику численности инфузорий при неоптимальном режиме температуры. На рис. 1-5 день внесения маточной культуры – первые сутки выращивания. Период культивирования инфузорий с апреля по июнь. Продукция изымалась с пятыхшестых суток выращивания. Плотность инфузорий приводится для поверхностного слоя культуральной среды, глубина – 10-20 см.
На рис. 1 показаны усредненные результаты по изменению плотности инфузории E. affinis в зависимости от состава вносимого корма, полученные в 1989, 2006, 2009 гг. Продолжительность выращивания – 10 суток.
На рис. 2 представляются усредненные данные по динамике плотности инфузории E. charon (2006, 2008, 2014 гг.) при выращивании с использованием кормовых дрожжей и питательной смеси на основе сена. Продолжительность – 10 суток.
В начале массового культивирования с применением питательных смесей плотность увеличивается от нескольких экз./мл до нескольких тысяч экз./мл в течение 4-6 суток (рис. 1, 2). В дальнейшем плотность резко возрастает до нескольких тысяч или сот тысяч экз./мл. В емкостях, где в качестве корма для кормления культуры инфузорий применялись только кормовые дрожжи, можно было наблюдать другую картину роста популяции инфузорий. В начальный период выращивания происходит очень медленное увеличение численности инфузорий до 2 суток, далее плотность увеличивается до 1-2 тыс./мл, после изъятия продукции сразу наступает стационарная фаза (6-8 сутки, численность остается почти на одном уровне). На 9-10 сутки инфузории перестают наращивать численность и культура «затухает». Меньшую численность инфузорий вида E. charon автор попыталась объяснить некоторыми причинами. Во-первых, инфузории вида E. charon почти в 2 раза больше по величине, чем предыдущий вид – E. affinis.
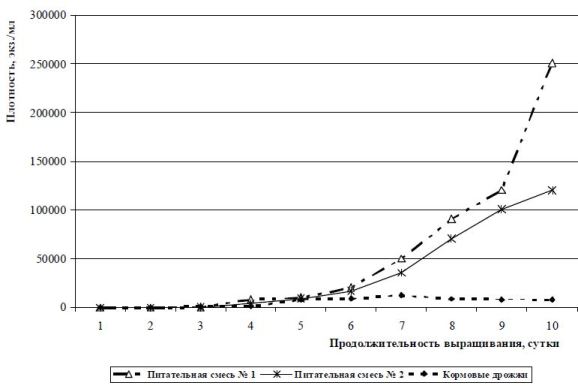
Рис. 1 Изменение плотности инфузории E. affinis в зависимости от состава вносимого корма, объем культуральной среды – 2000 л
Второй причиной является то, что в культуре инфузорий E. charon всегда присутствуют и инфузории вида E. affinis, которые могут вытеснить первый вид. Это происходит, если в питательной смеси с навозом содержание глюкозы и метионина составляет более 20 мг/м3. Поэтому численность инфузорий, полученная при культивировании, вполне достаточна, чтобы использовать этот вид для массового выращивания.
На рис. 3 приводится динамика (усредненный вариант за 2006, 2008 гг.) развития популяции инфузорий вида M. pulex. Продолжительность культивирования – 13 суток.
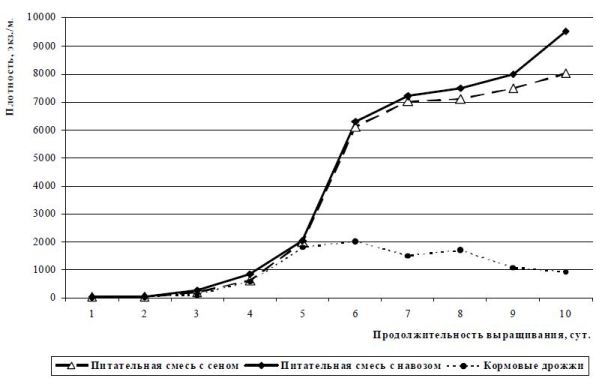
Рис. 2 Изменение плотности инфузории E. charon в зависимости от состава вносимого корма, объем культуральной среды – 2000 л
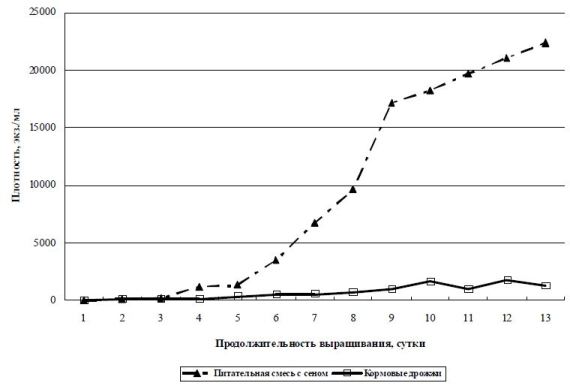
Рис. 3 Изменение плотности M. pulex в зависимости от состава корма, объем культуральной среды – 2000 л
По представленному рис. 3 можно проследить, что при использовании в качестве корма питательной смеси с сеном происходит увеличение численности инфузорий на несколько порядков выше, чем при кормлении «чистыми» кормовыми дрожжами. Инфузории M. pulex за период культивирования (13 суток) плотность увеличивают со 100-300 экз./л до 22000 экз./л. Питательная смесь с навозом при выращивании этого вида оказалась малоэффективной.
На рис. 4 показаны усредненные результаты (1989, 2008 гг.) выращивания инфузорий вида M. mediterranea. Продолжительность – 10 суток. По нему можно проследить, что инфузорий этого вида невозможно культивировать, применяя в качестве корма только кормовые дрожжи. На «чистых» дрожжах популяция данного вида не вступила даже в фазу замедленного роста. Применение питательной смеси с сеном дало положительный результат.
В то же время использование питательной смеси с навозом дало отрицательный результат. Численность популяции инфузорий медленно нарастала в период с 1 по 6 сутки от 7 экз./мл до 41 экз./мл. За период культивирования с 1 по 10 сутки плотность инфузорий возросла до 228 экз./мл.
Автор представляемой работы считает, что полученные результаты по массовому культивированию инфузорий р. Metacylis являются положительными по нескольким причинам. Во-первых, для своей размерной группы и анатомических особенностей (живут в специализированных «домиках») полученная численность инфузорий – более 200 экз./мл – довольно высокая; во-вторых, культивировался вид, для которого имеющаяся соленость (12-14 ‰) не являлась оптимальной; в-третьих, плотность инфузорий постоянно нарастала, даже при ежедневном удалении продукции. Максимальная плотность инфузорий, полученная при культивировании на питательных смесях, составила у вида E. affinis – 250080 экз./мл, у E. charon – 3500; M. pulex – 22360; M. mediterranea – 228, соответственно.
Автор считает, что следует также обратить внимание на то, что применение питательных смесей в качестве корма для инфузорий и кораллово-ракушечных фракций в качестве подстилающего слоя на дно бассейнов способствовало более интенсивному развитию фитопланктона. На рис. 5 представлен усредненный вариант изменения количественного состава микроводорослей при внесении питательных смесей в емкости, где производится культивирование зоопланктона.
По приведенному рис. 5 можно наблюдать, как изменяется численность микроводорослей в процессе внесения питательных смесей. До их внесения плотность фитопланктона в ранневесенний
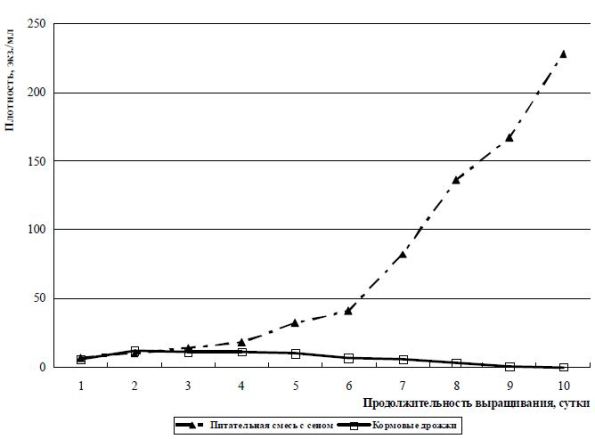
Рис. 4 Изменение плотности инфузории M. mediterranea в зависимости от состава вносимого корма, объем культуральной среды – 1000 л
период в водоемах, расположенных вдоль Керченского пролива, и в воде самого пролива, не превышает 0,5-2 млн. кл./л при температуре культуральной среды от 8 до 14 °С. После 5- или 8-кратного внесения питательных смесей плотность микроводорослей увеличивается от 5 млн. кл./л (5-е сутки) до 60 млн. кл./л (20-е сутки). Численность фитопланктона достигает своего максимума (90-120 млн. кл./л) на 35-40-е сутки культивирования, когда температура культуральной среды составляет 20-23 °С (рис. 5). При использовании в качестве корма только пекарских или кормовых дрожжей фитопланктон развивался очень медленно, в количественном отношении с 1-х по 10-е сутки – от 0,5-1 млн. кл./л до 2-4 млн. кл./л.
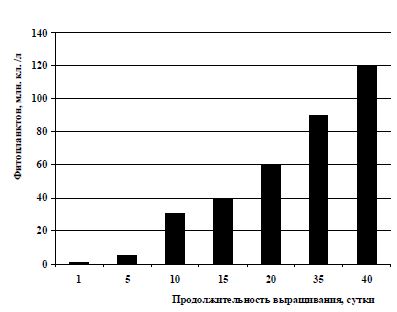
Рис. 5 Изменение количественного состава фитопланктона в результате применения питательных смесей
В качественном плане, при применении питательных смесей за 15 суток до внесения маточной культуры, культуральная среда всегда принимала четкий светло-зеленый оттенок, в отличие от первоначального – бурого цвета. В начале культивирования преобладал диатомово-динофитовый комплекс водорослей – Bacillariophyta: Nitzschia delicatissima, Coscinodiscus scutellum, Chaetoceros curvisetus; Dinophyta: Prorocentrum micans, Ceratium furca, в незначительных количествах встречались сине-зеленые водоросли – Cyanophyta. Это были в основном виды рода Lyngbya. После 10-кратного внесения смесей уже преобладали виды диатомовых, динофитовых и зеленых водорослей – Bacillariophyta: Cyclotella caspia, Chaetoceros curvisetus, Cocconeis scutellum, Coscinodiscus scutellum; Dinophyta: Prorocentrum micans, Exuviaela cordata, Gymnodinium wulfii, Glenodinium sp., Dunaliella viridis, Chlorella sp., Chlamydomonas sp., Platymonas sp., Scenedesmus sp., и одиночные сине-зеленые водоросли рода Microcystis.
При массовом культивировании инфузорий на питательных смесях очень редко наблюдались процессы конъюгации (половой процесс и ядерная реорганизация), которые обычно приводят к замедлению темпа размножения. Без обновления ядерного аппарата у инфузорий происходит гипертрофия макронуклеуса, рост и деление прекращаются. По мнению исследователей, процесс конъюгации замедляет темп увеличения численности, что нежелательно для массового культивирования [28, 29]. Многие авторы отмечают, что бесполое размножение (деление надвое), которое обуславливает постоянное увеличение численности, происходит при наличии достаточной и легкоусвояемой пищи и благоприятной температуры. В этом случае инфузории способны давать большую продукцию, как и все простейшие. Известно также, что инфузории могут размножаться без периодов конъюгации продолжительностью до 1000 суток без ущерба для популяции [1, 5, 15, 23].
Поэтому можно предположить, что используемые ингредиенты – это корм «соответствующего качества и количества».
ВЫВОДЫ
1. При содержании инфузорий в лабораторных условиях получены следующие данные: время генерации (с применением питательных смесей) для вида E. affinis составило 16,3 ч (на дрожжах – 30,1 ч); число делений в сутки – 1,5-2,9 и 0,6-0,8, соответственно. Удельная продукция при применении смесей составляла 1,0-1,5 сут.-1, без них – 0,4. Для вида M. pulex: время генерации с применением питательных смесей – 10,3, на дрожжах – 32,7 ч; число делений в сутки – 2,7-3,8 и 0,9-1,3, соответственно; удельная продукция при применении смесей составляла 1,6-1,8 сут.-1; без них – 0,7 (табл. 3).
2. При культивировании с использованием питательных смесей численность инфузорий E. affinis достигала 250000 экз./мл; E. charon – 9500; Mesodinium pulex – 22000; Metacylis mediterranea – 230, соответственно. При кормлении только кормовыми дрожжами плотность популяции E. affinis увеличивалась до18000 экз./мл; E. charon – 2000; Mesodinium pulex – 1500; Metacylis mediterranea – 20, соответственно. Поэтому массовое культивирование морских и солоноватоводных инфузорий рекомендуется проводить, используя различные химические и биологические добавки. Внесение смесей позволяет проводить выращивание даже при неоптимальной температуре. Это приводит к постоянному размножению культуры популяций, без периодов конъюгаций. Плотность организмов постоянно увеличивается, несмотря на ежедневное удаление 1/3 сырой биомассы.
3. Питательные смеси с витаминами, незаменимыми аминокислотами, полисахаридами и микроэлементами следует вносить в культуральные емкости за 15-30 суток до внесения маточной культуры.
4. Для выращивания инфузорий рекомендуется применять кормовые витамины группы В, глюкозу, кормовой метионин, азотнокислый натрий, кормовые дрожжи и органические удобрения.
Н. В. Новос?лова, ст. н. с.
Керченский филиал («ЮгНИРО») ФГБНУ «АзНИИРХ»
e-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.