Камбалы Азово-Черноморского бассейна (Bothidae, Scophthalmidae, Pleuronectidae, Soleidae)
Представителями отряда камбалообразные в Азово-Черноморском бассейне являются 11 видов — это арноглосса Кесслера Arnoglossus kessleri, европейская арноглосса A. later-na, арноглосса-пелудилья A. thori, глосса Platichtys luscus, камбала-калкан Scophthalmus maeoticus, гладкий ромб Scophthalmus rhombus, желтая солея Buglossidium luteum, ко-роткоперая солея Microchirus varitgatu, морской язык Pegusa lascaris; морской язык, или носатая солея, Pegusa nasuta; европейская солея Solea solea. Однако в Азовском и российской зоне Черного моря нами отмечены и исследованы лишь четыре вида — арноглосса Кесслера, глосса, камбала-калкан (с двумя подвидами) и морской язык, или носатая солея. По указанным видам приведены обобщенные данные за период 1993—2017 гг. по их распределению в различные сезоны года, возрасту наступления половой зрелости, размножению, возрастной и размерно-массовой структурах, запасах и добыче. Ключевые слова: Азовское море, Черное море, камбалы, камбала-калкан Scophthalmus maeoticus, глосса Platichtys luscus, арноглосса Кеслера Arnoglossus kessleri; морской язык, или носатая солея, Pegusa nasuta; распределение, возраст, размерно-массовые характеристики.
ВВЕДЕНИЕ
Подавляющее большинство видов отряда камбалообразные обитает в субтропических и тропических морях, часть видов — в морях умеренной зоны, а в арктические водах распределяются единичные виды. Камбалы — преимущественно морские рыбы, обитающие в прибрежной зоне, некоторые виды могут заходить в солоноватые и даже пресные воды. Взрослые рыбы, как правило, ведут донный образ жизни. По типу питания бентофаги и хищники. Питаются рыбами, донными ракообразными, моллюсками, червями и др. Размеры сильно варьируют от 6—7 см до 4—5 м (Никольский, 1971; Комарова, 2006). Камбалы по типу размножения относятся преимущественно к пелагофилам, вследствие чего эти виды обладают высокой плодовитостью — от 200 тыс. до 13 млн икринок. Видов, откладывающих донную икру, мало. Размножение происходит в прибрежной зоне или на мелководьях. Ранняя молодь камбал (личинки), обитающая в толще воды, имеет глаза, расположенные симметрично по бокам головы. При переходе к донному образу жизни, обычно это отмечается на стадии малька, происходит метаморфоз. Тело особей уплощается с боков, а один из глаз (обычно левый) перемещается на правую сторону тела, называемую глазной, левая сторона тела при этом — слепая.
Представители отряда являются важными промысловыми видами. Весь промысел приурочен к континентальному шельфу. Наиболее ценными являются палтусы (Никольский, 1971).
Рациональная эксплуатация запасов возобновляемых ресурсов является основной задачей любой промышленности. Управление запасами водных биоресурсов в современный период осуществляется на основе научно-обоснованного нормирования величины, селективности, времени и места промыслового воздействия на облавливаемую популяцию, т. е. путем регулирования рыболовства (Бабаян, 1997).
После распада Советского Союза в бассейнах южных морей практически перестала действовать научная система рыболовства и промысел приобрел слабоуправляемый характер. Перед рыбным хозяйством Российской Федерации в южных морях остро встал вопрос о наведении порядка в использовании федеральной собственности, какой и являются водные биоресурсы, на основе современных и репрезентативных научных данных. Все изложенное обусловило необходимость проведения исследований по оценке состояния запасов и распределения их структуры, разработки методик прогноза и сбора обширной кадастровой информации как научной базы управления промыслом.
По данным исследований видового состава рыб, в Азовском море обитают около 117 видов, в том числе морских 43, в Черном море насчитывается 181 вид, из которых морскими являются 119 видов. Таким образом, в Азово-Черноморском бассейне обитает около 300 видов и подвидов рыб. Из указанного количества видов представителями отряда камбалообразные (Pleuronectiformes) в Азовском и Черном морях являются 11 — это арноглосса Кесслера Arnoglossus kessle-ri Schmidt, 1915, европейская арноглосса A. laterna Walbaum, 1792, арноглосса-пелу-дилья A. thori Kyle, 1913 (Bothidae), глосса Platichtys luscus Pallas, 1814 (Pleuronectidae), камбала-калкан Scophthalmus maeoticus Pallas, 1814, вероятно, с двумя подвидами, гладкий ромб Scophthalmus rhombus Linnaeus, 1758 (Scophthalmidae), желтая солея Bu-glossidium luteum Risso, 1810, короткоперая солея Microchirus varitgatu Donovan, 1808, морской язык Pegusa lascaris Risso, 1810, морской язык, или носатая солея, Pegusa nasuta Pallas, 1814, европейская солея Solea solea Linnaeus, 1758 (Soleidae) (Парин и др., 2014). Промысловыми являются камбала-глосса и два подвида калкана — азовский
Scophthalmus maeoticus torosa и черноморский S. maeoticus maeoticus. Морской язык (носатая солея) и камбала-арноглосса встречаются редко, а остальные виды в российских водах Черного моря нами не отмечены.
Цель работы — анализ и обобщение многолетних материалов по камбалообразным российской зоны Черного и Азовского морей. Уточнение их видового состава, биологического состояния популяций (размерно-массовая, возрастная, половая и пространственная структуры), а также питания, воспроизводства и влияния на них природных и антропогенных факторов, отмечавшихся в Азово-Черноморском бассейне.
МАТЕРИАЛ И МЕТОДИКА
В работе проанализирован обширный материал, собранный в учетных съемках, на контрольно-наблюдательных пунктах и при мониторинге промысла в Азовском и Черном морях. За время проведения исследований авторы приняли участие в 43 учетных лампарных съемках, 22 учетных траловых съемках и 12 рейсах на промысловых судах при проведении мониторинга промысла в Азовском море; 42 учетных траловых съемках, 10 рейсах на промысловых судах и 28 береговых экспедициях по бригадам прибрежного лова в Черном море. Исследования охватывали всю акваторию Азовского и северо-восточную часть Черного
морей, а в 1994-1995 и 2015-2017 гг. еще и
побережье Крымского полуострова.
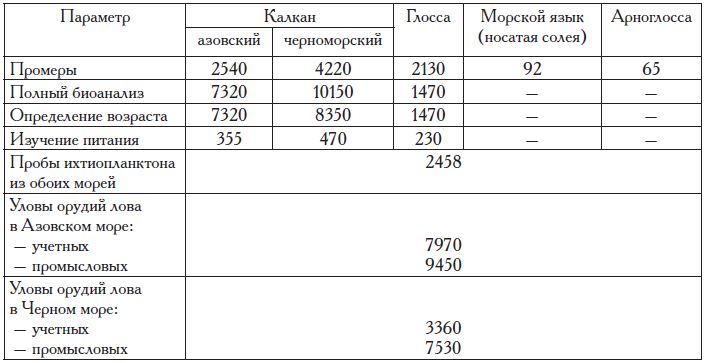
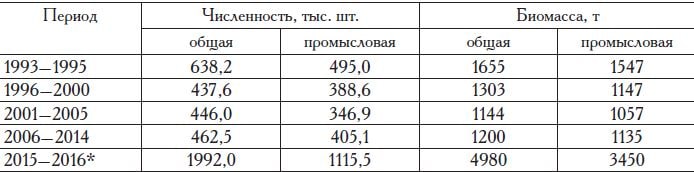
Сбор материалов проводили по стандартной сетке станций мелкоячейной лампарой длиной 173 м по верхней подборе с минимальным размером ячеи 6,5 мм; 25-метровым донным и 31-метровым разноглубинным тралами с ячеей в кутце 6,5 мм, а также ихтиопланктон-ной конусной сетью ИКС-80 из мельничного газа № 15. Кроме того, в работе использованы данные, полученные с помощью промысловых орудий лова: разноглубинных тралов, ставных неводов, ставных сетей, наживных крючьев. Объем собранного и обработанного материала по камбалам Азово-Черноморского бассейна представлен в табл. 1.
Таблица 1. Объем собранного и обработанного материала по камбалам Азово-Черноморского бассейна за период с 1993 по 2017 гг., экз.
Биологический анализ рыб включал: индивидуальное измерение длины с точностью до 1,0 см, определение массы с точностью до 10 г, пола и стадии зрелости половых продуктов, сбор материала для определения возраста и состава пищи. Измерения проводили путем помещения рыб на ровную горизонтальную линейку. Определяли длину рыб от вершины рыла (при закрытом рте) до основания средних лучей хвостового плавника.
Определение пола и стадий зрелости половых продуктов, сбор других ихтиологических материалов производили по методике Правдина (1966).
Для определения возраста производили сбор отолитов. Использовали методику определения возраста рыб, изложенную в работе Чугуновой (1959).
Для определения эффективности размножения морских рыб в период выполнения учетных траловых съемок и дополнительно в некоторых бригадах прибрежного лова в Азовском и Черном морях проводили обловы ихтиопланктонной конусной сетью ИКС-80 при циркуляции судна в течение 10 мин (Методы ..., 2005). Для удобства изложения
материала по распределению рыб на ранних стадиях развития по сезонам года акваторию шельфа Черного моря условно разделили на три части по глубине: прибрежную (до 20 м), мелководную (21—50 м) и глубоководную (51-100 м).
Величину запасов камбал определяли методом прямого учета при проведении траловых съемок. На основании данных, полученных в траловых уловах, определяли биологическое состояние популяций, их общую и промысловую биомассу, динамику численности поколений. Учет калкана в Азовском море проводили 25-метровым донным, а в Черном — 31-метровым разноглубинным тралом в донном варианте траления. Площадь облова за траление составляла 0,23 и 0,27 км2/ч соответственно. Биомассу камбал определяли по формуле (Майский, 1967): В = Бт/зк, где Б — площадь моря (района), км2; т — средний улов на станции, кг; 5 — площадь облова трала, км2/ч; к — коэффициент уловистости трала.
При расчете биомассы применяли коэффициент уловистости для калканов и глоссы, равный 0,15 (Серобаба, Шляхов, 1989).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На основании собранного и обработанного материала в Азовском и российской зоне Черного морей мы отметили следующих представителей отряда камбалообразные: камбал-калканов азовскую и черноморскую, камбалу-глоссу, морского языка (носатую солею) и арноглоссу.
Азовская камбала-калкан имеет высокое, но относительно короткое тело, сильно уплощенное с боков, овальной формы. На глазной стороне тело покрыто многочисленными небольшими костными бугорками — шипиками (которые у молодых рыб иногда отсутствуют). Окраска глазной стороны зеленовато-буроватая с переходом по краям в серый цвет с темно-оливковыми пятнами. Слепая сторона светлая, иногда с желтовато-серыми пятнами (Состояние ..., 1995). Основной пищей молоди являются ракообразные, взрослые же рыбы преимущественно хищники. Нерест начинается в конце апреля и продолжается до середины июня. Икра пелагическая (Световидов, 1964; Состояние ..., 1995; Васильева, Луж-няк, 2013).
По данным наших исследований, калкан встречается в море почти на всей акватории, кроме приустьевых зон рек. Ведет придонный образ жизни, часто закапываясь в грунт. В весенне-летний период калкан держится в прибрежной полосе на глубинах от 2 до 6 м, где происходит его размножение. В период нагула концентрируется в прибрежной зоне Белосарайского, Бердянского, Обиточного заливов и у побережья Крыма от Арабатской стрелки до Керченского пролива. У Кубанского побережья моря встречается в меньшей степени. С началом осеннего охлаждения воды постепенно мигрирует в центральную часть моря к месту зимовки, которая проходит на глубинах более 10 м.
В летний период азовский калкан лежит на дне, почти полностью закопавшись в песок. По типу питания — засадный хищник. Основу пищевого комка (около 70%) составляют бычки (СоЬ^ае), в меньшей
степени (порядка 27%) в содержимом желудков встречаются тюлька Clupeonella cultriventris, хамса Engraulis encrasicolus, атерина Atherina boyeri, а ракообразные и моллюски составляют незначительную часть рациона.
Популяция камбалы-калкан в Азовском море насчитывает 9 возрастных групп (табл. 2). В уловах учетных и промысловых орудий лова встречаются все группы, кроме сеголеток, которые обитают в узкоприбрежной зоне и облавливаются крайне редко. Максимальный отмеченный нами промысловый размер азовского калкана составляет 42 см, а масса — 1750 г.
Половой зрелости самцы достигают в возрасте 3—4 года, а самки — на 3—6-м году жизни. Полное вхождение поколения в нерестовую часть популяции происходит на 6-м году жизни, когда созревают все самки (табл. 3). Соотношение полов в стаде характеризуется равенством самцов и самок.
Массовое размножение азовского калкана отмечается с середины мая до первых чисел июня. В 1990-х гг., в период удовлетворительного состояния запасов, икра калкана по акватории Азовского моря распределялась отдельными скоплениями в основном в центральной и западной частях моря (рис. 1). Ранняя молодь облавливалась в основном в июне.
Распреснение Азовского моря отрицательно сказалось на воспроизводстве камбалы. С 2000 г. ранняя молодь практически не встречается в уловах ихтиопланкто-на. Отдельные ее экземпляры облавливали в
2005-2006 и 2008-2009 гг. (табл. 4).
С 2007 г. повышается соленость Азовского моря, в 2016-2017 гг. она достигла уровня 14%о, что создает хорошие условия для получения жизнестойких поколений молоди камбалы. Однако популяция калкана в Азовском море эксплуатируется весьма интенсивно, особенно с конца 1990-х гг., что привело к снижению промыслового запаса с 4,0-5,6 тыс. т в 1980-1985 гг. до 0,05-0,06 тыс. т в 20152017 гг. Низкая численность производителей
Таблица 2. Среднемноголетние возрастная и размерно-массовая структуры камбалы-калкана в Азовском море в 1993-2017 гг.
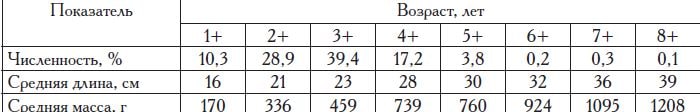
Таблица 3. Динамика достижения половой зрелости азовской камбалы-калкана и средние размер ные характеристики особей по возрастным группам в 1993-2017 гг.
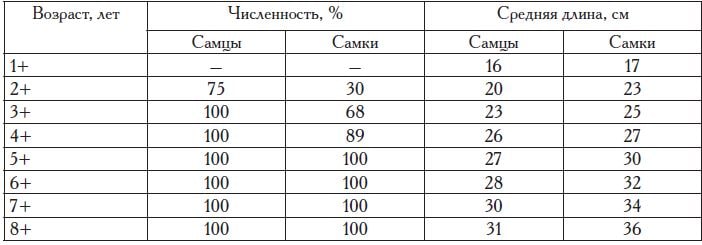
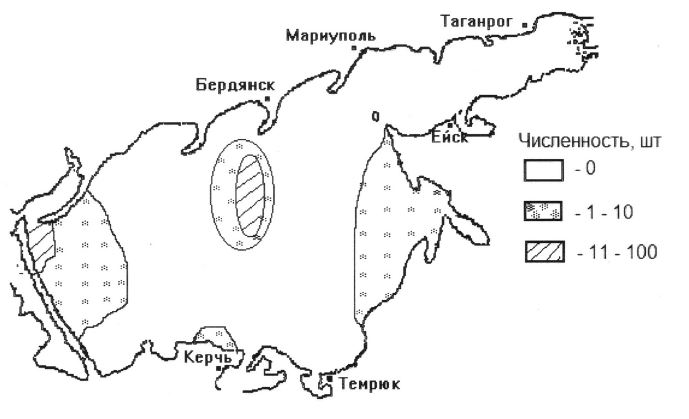
Рис. 1. Распределение икры азовского калкана в мае 1999 г. , шт/сеть.
не способствует эффективному воспроизводству популяции, в результате чего ежегодное пополнение азовского калкана происходит за счет крайне низкоурожайных поколений. В результате численность и биомасса популяции снижаются (табл. 5).
В настоящее время популяция находится в депрессивном состоянии, и ее восстановление займет не менее 5 лет даже при полном запрете промысла.
В литературе нет единого мнения о наличии азовского калкана в Черном море, большинство источников этот вид в Черном море не указывают (Марти, 1939; Свето-видов, 1964; Дехник, 1973; Состояние ..., 1995; Емтыль, Иваненко, 2002).
В 1993—2017 гг. в российской части черноморского шельфа в уловах тралов и ставных неводов отмечено более 140 экз. азовского калкана. Определение проводили по методике Световидова (1964). Отмечался он на обширной акватории российской части Черного моря от Феодосийского залива до Геленджика на глубинах от 10 до 50 м, наиболее часто — на глубинах 25—35 м (На-долинский и др., 1998).
Сравнительный анализ размера и роста калкана из Азовского и Черного морей свидетельствует об отсутствии существенных различий по этим показателям у азовского и черноморского стад азовского калкана и о значительным опережении в темпе роста черноморского калкана (табл. 6).
Первое половое созревание у калканов как Черного, так и Азовского морей наступает на 3—4-м году жизни; первыми созревают самцы, самки — на год позже.
Массовый нерест отмечается в мае. Соотношение полов в стаде равное.
Камбала-калкан черноморская. Черноморский калкан — ценный промысловый вид, встречается по всему побережью Черного моря. Донный оседлый хищник, вследствие чего не совершает длительных миграций вдоль побережья, а только местные перемещения, связанные с нагулом и воспроизводством. Предпочитает песчаные и илисто-песчаные грунты, образует несколько локальных стад (Попова, Винарик,
1979; Шишло, 1993; Zengin, Duzgunes, 2003; Васильева, 2007). В российской части моря встречаются представители анапского, северокавказского, крымского и частично северо-западного стад.
Сильно сжатое с боков (почти круглое), плотное тело. Оба глаза на левой стороне. Большой, наклонный, конечный рот. Начало основания спинного плавника расположено впереди верхнего глаза. Спинной и анальный плавники заканчиваются на хвостовом стебле. Лучей в спинном плавнике 57— 80, в анальном — 43—58. Грудной плавник зрячей стороны длиннее плавника слепой,
Таблица 4. Средние уловы личинок азовского калкана в июне 1993—2017 гг., шт/сеть
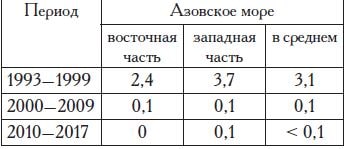
Таблица 5. Средняя численность и средняя биомасса азовской камбалы-калкана в период 1993 — 2017 гг.
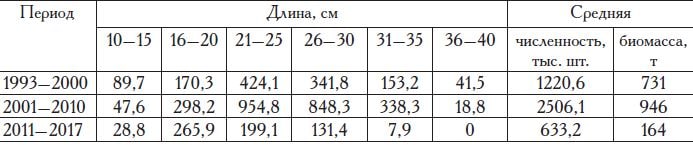
Таблица 6. Средние длина и масса поколений азовского и черноморского калканов в период 1993 — 2017 гг.
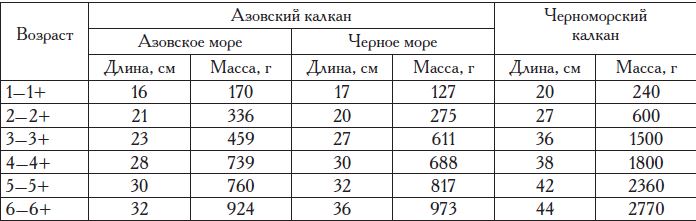
Таблица 7. Распределение черноморской камбалы-калкана в северо-восточной части Черного моря в различные сезоны года в период 1993—2017 гг., % от численности стада
брюшные имеют длинные равные основания. Хвостовая лопасть округленная. Боковая линия на обеих сторонах хорошо развита и сильно изогнута над грудными плавниками. Окраска различная: от серовато-коричневой до рыжей вследствие значительной мимикрии, оттенок зависит от цвета субстрата. Как глазная, так и слепая стороны покрыты округлыми костными бугорками с шипиком посередине. Костные шипы больше, чем диаметр глаза, и располагаются обычно на обеих сторонах тела.
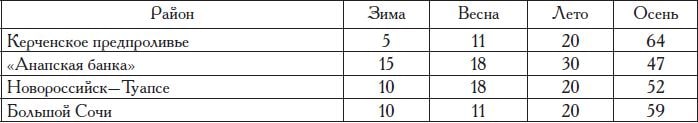
Распределение этой камбалы вдоль побережья России неравномерно и в значительной мере зависит от ширины шельфовой зоны. Максимально камбалы всех размерных групп северо-восточной части моря встречаются на участках с широким шельфом — в Керченском предпроливье и запретном пространстве «Анапская банка», а минимально — на участке Туапсе—Адлер (Большой Сочи), где ширина шельфа наименьшая (табл. 7).
Молодь камбалы, особи длиной до 40 см, предпочитают глубины до 50 м, что
совпадает с данными предыдущих исследователей (Марти, 1939; Попова, 1954). В теплое время года наиболее крупные особи мигрируют в глубоководную часть шельфа и переходят в группу пополнения (табл. 8).
Особи группы пополнения (длина 41—45 см) и остатка (более 45 см) зимуют в основном за 50 м изобатой. Весной отмечается их миграция в мелководную часть шельфа на нерест, который проходит в основном на глубинах 36—50 м. После его окончания, в период нагула, распределение особей этих размерных групп по глубинам не меняется, а ближе к зиме они мигрируют на большие глубины.
По данным исследователей (Марти, 1939; Попова, 1966), половая зрелость черноморской камбалы-калкана наступает в основном на 5—6-м и даже 7—8-м годах жизни, а особи, созревающие в возрасте 3—4 лет, составляют не более 3—5% численности. На основании наших исследований, проведенных в весенне-летний период, установлено, что первые зрелые самцы калкана встречаются в возрасте двухгодовика, а самки — в трехгодовалом возрасте, составляя четвертую и шестую часть поколения соответственно. Массовое созревание поколения происходит в 3—4-годовалом возрасте, а полное созревание — в 6-7-годовалом, когда созревают все самки (табл. 9).
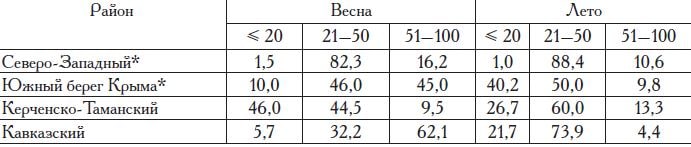
Весной (в середине марта) первые текучие самки черноморской камбалы-калкана отмечаются на юге Кавказского района. Массовый нерест здесь проходит с конца марта— начала апреля до середины июня. В северной части этого района массовое размножение происходит несколько позже, с середины апреля по конец июня. Самое позднее начало размножения отмечается в Керченско-Та-манском районе и у побережья Крыма: здесь массовый нерест проходит в мае—июне, и к началу июля он завершается (табл. 10).
Основные места концентрации икры камбалы — поверхностные слои воды (Дех-ник, 1973). В результате ее распределение в период размножения в значительной мере зависит от ветровой активности над акваторией
Таблица 8. Распределение черноморской камбалы-калкана в северо-восточной части Черного моря по глубинам в различные сезоны 1993 — 2017 гг., % от численности стада
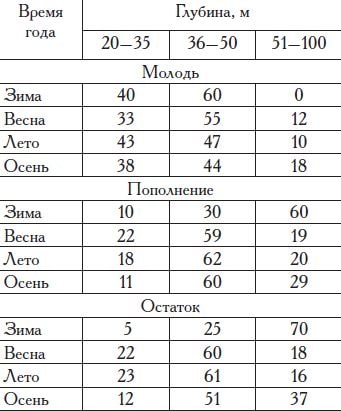
Таблица 9. Достижение половой зрелости черноморской камбалы-калкана разных возрастных групп в весенне-летний период 1993 — 2017 гг., %
Возраст, лет Самцы Самки
2 23 0
3 76 16
4 96 58
5 98 82
6 100 91
7-15 100 100
моря. Северо-Западный и Керченско-Таман-ский районы обладают широким шельфом, в результате чего основная масса выметанной икры не выносится за пределы мелководной части шельфа. У Южного берега Крыма и в Кавказском районе шельфовая зона значительно уже, и весной в период высокой ветровой активности максимальные концентрации икры калкана отмечаются над глубоководной его частью. Летом же здесь чаще отмечаются
Таблица 10. Распределение икры черноморской камбалы-калкана над глубинами (м) в территориальных водах России в Черном море по сезонам за период 1993—2017 гг., %
Примечание. *Данные за 2015—2017 гг., осенью икру не обнаружили.
«штилевые погоды», и икра облавливается в основном над глубинами до 50 м.
Личинки калкана в уловах ихтиоплан-ктона встречаются крайне редко, в наших уловах за весь период исследований отмечено только две личинки над мелководной частью шельфа в Керченско-Таманском районе.
Продолжительность массового нереста камбалы составляет около двух месяцев. Наибольшая численность икры в уловах ихтиопланктонных сетей отмечается в Кавказском районе в апреле—мае, в Керченско-Таманском районе в мае—июне, а у побережья Крыма с конца апреля до начала июня. В среднем на один облов ихтиопланктонной сети за весь период наблюдений приходится 3—5 икринок калкана в Кавказском районе, 2—6 икринок — в Керченско-Таманском и 1—3 икринки — у побережья Крыма. Икра и личинки калкана распределяются в поверхностных слоях воды.
Однако, если нерест проходил в глубоководной части шельфа, икра и ранняя молодь камбалы выносятся из шельфовой зоны в открытое море, где попадают в систему прибрежных поверхностных течений, стрежень которых проходит в 20—25 милях от берега. Средняя скорость этих течений составляет 0,2—0,4 м/с (Промысловое описание ..., 1988). Следовательно, личинки камбалы за два месяца могут быть перенесены на расстояние около 2000 км (более 900 миль). Вероятно, часть молоди к моменту перехода к донному образу жизни успевает оказаться над шельфом Турции.
Максимальный темп линейного роста происходит у камбалы в первые три года жизни, а весового — в период первого полового созревания (табл. 11). С возрастом линейный рост замедляется и на 5-10-м годах жизни составляет 3-4 см в год, а у более старших возрастных групп — 1-2 см. Весовой темп роста после достижения половой зрелости стабилизируется на уровне 500—700 г в год. До четырехлетнего возраста самцы и самки растут одинаково, в дальнейшем у самцов темп размерно-весового роста замедляется быстрее, чем у самок (рис. 2). Максимальные размерно-массовые характеристики самцов калкана, по нашим данным, составляют 59 см и 9,6 кг, а самок — 71 см и 12,2 кг.
В младших возрастных группах соотношение полов примерно одинаковое, а с 8—9-летнего возраста начинают преобладать самки.
В состав пищи камбалы в этот период входят мерланг Merlangius merlangus euxinus — 42%, шпрот Sprattus sprattus phalericus — 20%, бычки Gobiidae — 18%, барабуля Mullus barbatus ponticus — 17%, остальные 3% приходятся на ракообразных Crustacea, в основном креветок Decapoda. Максимальное количество ракообразных потребляет молодь — до 20% от массы пищевого комка. Взрослые особи потребляют их в меньшем количестве, не более 1%. На глубинах до 35 м, где обитает в основном молодь, в пищевом комке желудков особей присутствуют все перечисленные организмы. У камбал, выловленных под слоем термоклина
Таблица 11. Распределение численности (I, %), средней длины (II, см) и массы (III, г) черномор ской камбалы-калкана по возрастным группам в период 1993—2016 гг.
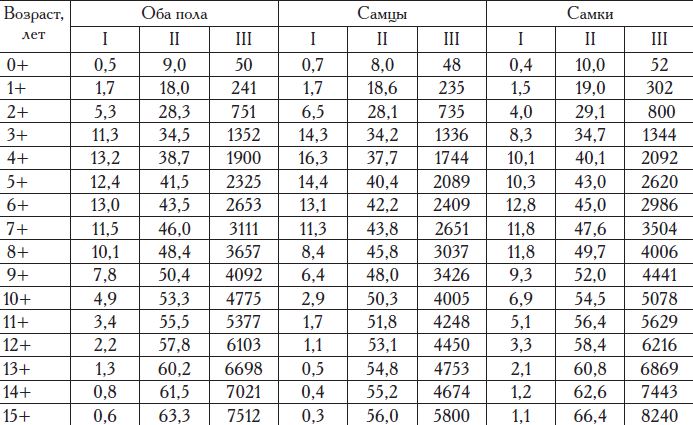
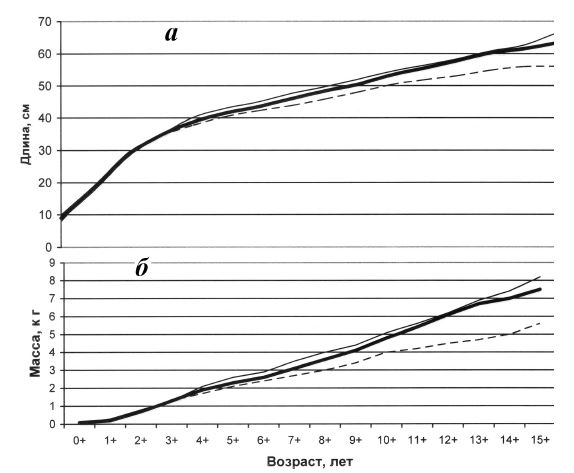
Рис. 2. Темп линейного (а) и весового (б) роста черноморской камбалы-калкана по возрастным группам в период 1993-2016 гг.: (-) - самки, (---) - самцы, (— ) - оба пола.
Таблица 12. Распределение численности и биомассы черноморской камбалы-калкана по периодам в 1993-2016 гг.
Примечание. *С учетом побережья Крыма.
(35-50 м), где распределяется основная масса производителей, в состав пищи входят только шпрот (55%) и мерланг (45%). У особей из глубоководной части шельфа (> 50 м) пищевой комок в желудке на 90-100 % заполнен мерлангом. К середине осени калкан переходит на питание азовской хамсой Engraulis encrasicolus maeoticus, зимовальная миграция которой в российской зоне моря отмечается с сентября по декабрь.
В период исследований численность и биомасса популяции калкана в российском территориальном море менялась в значительных пределах (табл. 12).
В конце 1990-х г., по данным учетных траловых съемок, стало отмечаться снижение численности и биомассы популяции черноморского калкана. Причиной этого явления стал сетной промысел камбалы в 1994-1999 гг., получивший большое развитие после снятия запрета на добычу этого вида. В это время на основных нерестилищах и подходах к ним (протяженностью 156 км по 50-метровой изобате) выставлялось от 110 до 180 км только разрешенных камбальных и катраньих сетей, которые зачастую не снимались даже в период 10-15-суточного запрета на промысел в период нереста калкана.
Введение с 2000 г. по нашим рекомендациям поэтапного полуторамесячного запрета на промысел камбалы в период массового ее нереста способствовало свободному проходу производителей на традиционные нерестилища в мелководной части шельфа и
появлению урожайных поколений в 20002003 гг. Однако значительное изъятие производителей и малопродуктивный нерест в 1994-1999 гг. сказывались на состоянии нерестовой части популяции камбалы до конца 2000-х гг. В начале 2010-х гг. для сохранения наиболее продуктивной части нерестового стада камбалы-калкана была увеличена промысловая мера с 35 до 40 см, это повлекло увеличение минимального размера ячеи в камбальных сетях, что способствовало появлению двух следующих друг за другом урожайных поколений.
Камбала-глосса. Морская солоно-ватоводная рыба, приспособленная к жизни как в соленых, так и в опресненных лиманах. Глосса внешне хорошо отличается от калкана. Тело ее ромбическо-овальной формы, сильно уплощенное с боков. Покрыто чешуей, погруженной в кожу, а не налегающей одна на другую, как у большинства рыб. При основании спинного и анального плавников имеются костные пластинки - бугорки. Спинной плавник начинается над глазом по краю тела, а анальный - несколько сзади от конца жаберной крышки. Задние концы этих плавников не достигают основания хвостового плавника. Глазная сторона тела имеет грязно-зеленоватую окраску с бурыми звездчатыми пятнами, а слепая почти белая. Камбала-глосса достигает длины 37 см и массы 930 г, питается моллюсками, ракообразными и другими видами бентоса. Икрометание происходит в холодное время года (январь-март). Основным
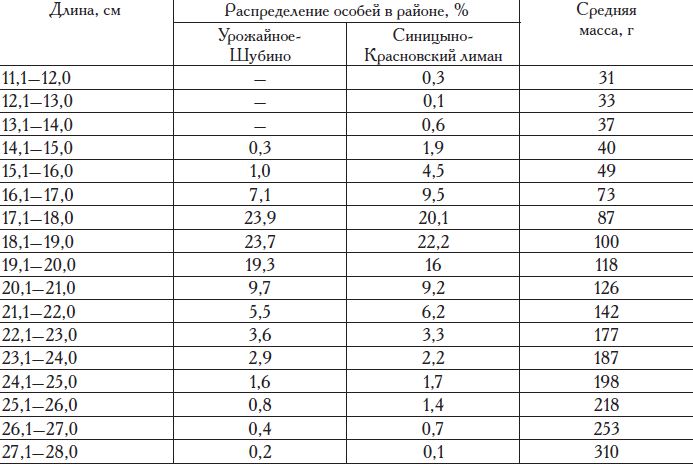
Таблица 13. Распределение камбалы-глоссы по размерам и средней массе в уловах* контрольно-наблюдательных пунктов ЮгНИРО в различных районах восточной части Сиваша в 2001 г.
Примечание. *Использовали сети и каравки с размером ячеи 45 — 75 мм, « — » — нет в улове.
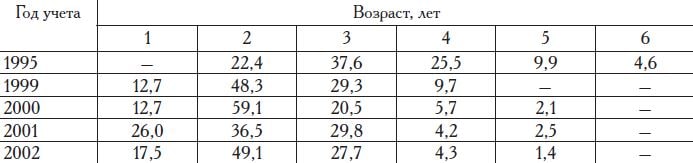
Таблица 14. Распределение камбалы-глоссы в восточной части Сиваша по возрастным группам, %
Примечание. По данным учетных съемок механизированной драгой Азовского отделения ЮгНИРО в 1995-2002 гг.; «-»- нет в улове.
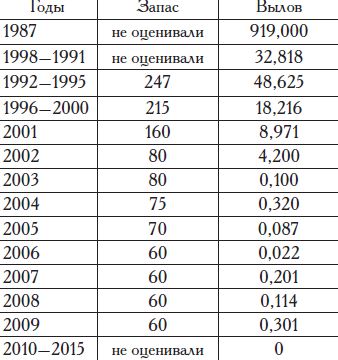
районом обитания является восточная часть Сиваша, где распределяется самая многочисленная популяция этого вида и размножается основная масса нерестового стада Азовского моря. В период с 1979 по 1986 гг. средний годовой улов глоссы составлял 615,3 т, а рекордный (1986 г.) — 918,7 т. С 1987 г. запасы этого вида имеют четкую тенденцию
к снижению, в 1990 г. улов глоссы составил 96,7 т, а в 1991 г. — 70 т (Состояние ..., 1995).
По нашим исследованиям, в заливе Сиваш Азовского моря камбала-глосса достигает длины не более 30 см и возраста 5 лет (табл. 13, 14). Созревает глосса в возрасте 3—5 лет.
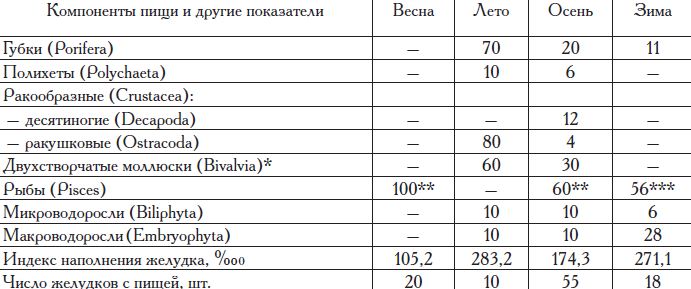
Таблица 15. Частота встречаемости компонентов в пище камбалы-глоссы на юге Сиваша (район Красновского лимана) в разные сезоны 2001 г., %
Примечание. *До 70% составляла абра Abra ovata, **96—100% составляли атерины Atherina, ***100% составляли бычки Gobiidae.
Массовый нерест происходит с середины января до конца февраля. Плодовитость глоссы 0,4—2,0 млн икринок, икра пелагическая. Оптимальной для нереста и нагула камбалы-глоссы является соленость воды в диапазоне 25—30%о, а при солености ниже 20 и выше 50—60о%о эффективность нереста резко снижается. Оптимальная температура развития икры — 2—15°С. Камбала-глосса питается ракообразными (Gammaridae), моллюсками (Hydrobia, Syndesmya, Loripes, Cardium), червями (Nereis, Nephthys, Clymene, Pectinaria и др.) и рыбой (бычками). В питании глоссы на юге Сиваша выявлена сезонная изменчивость (табл. 15): весной и зимой ее пища состоит в основном из рыбы, летом и осенью кроме рыбы в питании присутствует значительная доля ракообразных и двухстворчатых моллюсков.
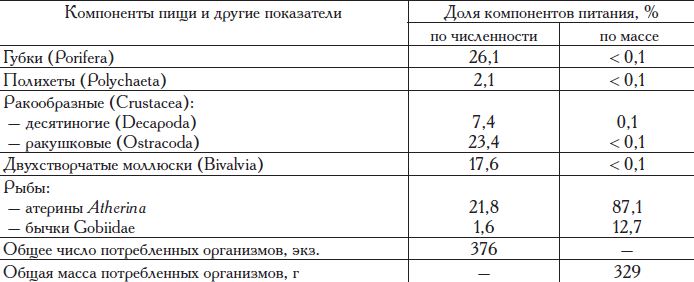
Поскольку наибольшее количество проб на питание было собрано осенью, этот сезон охарактеризован более подробно. Рыба в осенние месяцы по частоте встречаемости в желудках составляла 60%, а в общей массе пищевого комка она абсолютно доминировала, составив 99,9% (табл. 16), что характеризует сивашскую камбалу-глоссу как типичного хищника.
До ввода в эксплуатацию СевероКрымского оросительного канала восточная часть Сиваша, исключая его северную часть, являлась ультрагалинным водоемом с уровнем солености 91—166%о, что неблагоприятно для обитания камбалы-глоссы и других промысловых рыб. С 1971 г. началось общее распресне-ние восточной части Сиваша под действием днепровских сбросных и дренажных вод. К началу 1980-х гг. вода в крымских районах восточной части Сиваша распреснилась до что создало благоприятные условия для воспроизводства, нагула и промысла камбалы-глоссы, численность которой резко увеличилась. Для ее лова применялись преимущественно полумеханизированные драги (до 25 ед.) и каравки (до 35 ед.), максимальный исторический вылов был достигнут в 1987 г. — 919 т (табл. 17).
Дальнейшее распреснение и сильное зарастание Сиваша макрофитами вызвало стремительное уменьшение площади нерестилищ: с 1986 по 1989 гг. площадь акватории залива с оптимальной для нереста соленостью сократилась в четыре раза, а спустя несколько лет в восточной части Сиваша практически не
Таблица 16. Характеристика осеннего питания камбалы-глосса юга Сиваша (район Красновского лимана) в 2001 г.
осталось участков с благоприятным для воспроизводства глоссы уровнем солености. После 2014 г. в связи с прекращением сброса пресной воды в Сиваш соленость залива у берегов Крыма вновь повысилась и в 2016 г. составила: в северной части (у с. Мысовое Джанкой-ского района) — 30°%о, в центральной части (у с. Дмитровка Советского района) — 58°%о и в южной кутовой его части — 75°%о. Это дает некоторую надежду на улучшение условий воспроизводства камбалы-глоссы и частичное восстановление ее запаса в заливе Сиваш Азовского моря.
В Черном море глосса, благодаря своей эвригалинности, широко распространена по всем берегам моря и в соленых лиманах (Назаров, Чупурнова, 1969). Она предпочитает илистые грунты, встречается даже на участках, в значительной степени заражен -ных сероводородом. Спектр питания глоссы довольно обширен, что позволяет ей мигрировать почти по всей ширине шельфа, до зоны сероводорода (Воробьева и др., 1976).
Черноморская глосса — холодолю-бивый донный зообентофаг, ведущий относительно оседлый образ жизни, мигрирует только с больших глубин на мелководья и обратно. Основным районом обитания глоссы в российском территориальном море является участок шельфа от Новороссийска до Адлера (табл. 18). Здесь распределяется от 70
Таблица 17. Запас и вылов камбалы-глоссы в морских водах, прилегающих к Крыму, (Азовское море, залив Сиваш) в 1987—2015 гг., т
до 80% всей ее популяции российской зоны Черного моря. В период гомотермии глосса распределяется относительно равномерно по всей ширине шельфа. С началом образования слоя термоклина она концентрируется в холодном слое воды, а в прибрежной зоне моря в этот период отмечается в небольшом количестве (табл. 19).
Таблица 18. Распределение камбалы-глоссы в северо-восточной части Черного моря по районам и сезонам года, %
Половая зрелость наступает у самцов глоссы в возрасте четырех лет (3+), а у самок на год позже (табл. 20).
Как и у всех холодолюбивых видов рыб, нерест глоссы проходит в холодное время года. По нашим данным, во второй половине ноября гонады у самок находятся на стадии зрелости III—IV, а в конце января—начале февраля — на стадии VI—II. Таким образом, нерест камбалы-глоссы отмечается в декабре—январе, что соответствует данным других исследователей (Назаров, Чупурнова, 1969; Воробьева и др., 1976). Однако нерест отдельных особей, по данным траловых и ихтиопланктонных съемок, проведенных нами в 1993—2017 гг., может отмечаться и в мае. В этот период икра глоссы в Керченско-Таманском районе облавливается в мелководной части шельфа, над глубинами 21—50 м, а в Кавказском — за пределами узкоприбрежной зоны (21—100 м). Личинки облавливались практически над всей шель-фовой зоной (табл. 21).
В посленерестовый период глосса интенсивно нагуливается, индексы наполнения кишечника у нее колеблются в пределах 100—300%оо, составляя в среднем 198%оо. Основу пищевого комка составляют моллюски Abra и полихеты Nereis и Nephthis. Интенсивный нагул продолжается в течение всего теплого времени года.
Соотношение полов в популяции характеризуется значительным преобладанием самок — 70—75 % (табл. 22). Популяция черноморской глоссы насчитывает 10 возрастных групп (Надолинский и др., 1998). В учетных орудиях лова встречаются все группы, кроме сеголеток-годовиков, кото-
Таблица 19. Распределение камбалы-глоссы по глубинам в различные сезоны года, %
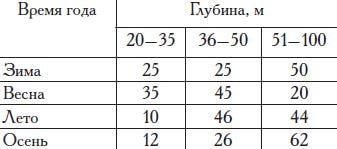
Таблица 20. Распределение самцов и самок черноморской камбалы-глоссы в стадии половой зрелости по возрастным группам в весенне-летний период 1993—2017 гг., %
Возраст, лет Самцы Самки
1+ 0 0
2+ 58 0
3+ 100 53
4+ - 9+ 100 100
Таблица 21. Распределение глоссы ранних стадий развития над глубинами в шельфовой зоне северо-восточной части Черного моря в весенний период, %
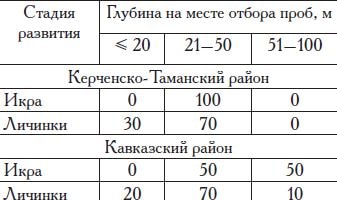
Таблица 22. Распределение численности (Ы), средние длина (Ь) и масса (Р) черноморской популяции глоссы по возрастным группам
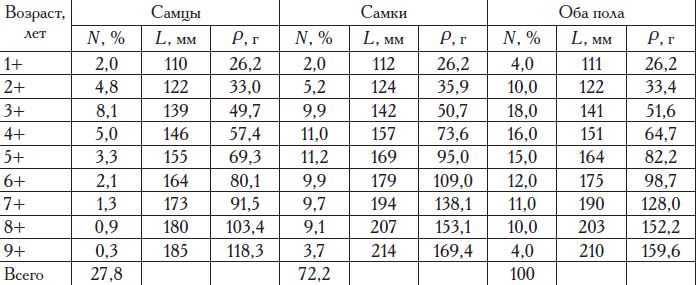
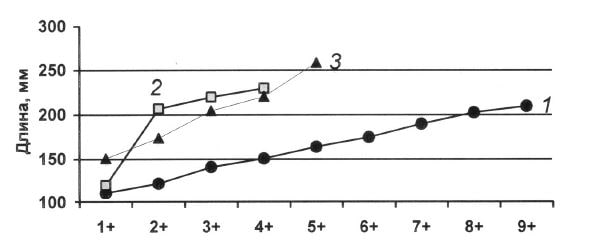
Рис. 3. Темп линейного роста камбалы-глоссы по возрастным группам: 1 — Черное море, 2 — Хад-жибеевский лиман (по: Хоросанова, 1949), 3 — восточная часть Сиваша.
рые обитают в узкоприбрежной зоне. Единичные их экземпляры отмечаются в уловах ставных неводов в осенне-зимний период, длина их колеблется в пределах 55—61 мм. Неполовозрелая молодь в возрасте 2—3 лет встречается в траловых уловах в небольшом количестве вследствие своих размеров.
Темп линейного роста камбалы-глоссы, обитающей в море, заметно ниже, чем в лиманах северо-западной части Черного моря (Хоросанова, 1949) и восточной части Сиваша (рис. 3).
Промысловый запас глоссы в северо-восточной части Черного моря в 1990— 2000 гг. оценивался в 900 т, в настоящее
время вследствие редкой встречаемости данного вида в уловах учетных орудий оценить запас не представляется возможным. Специализированного промысла глоссы в Черном море не ведется, однако она прилавливается при траловом промысле азовской хамсы и черноморского шпрота, составляя в среднем 0,1 кг на 1 т хамсы или шпрота.
Морской язык (носатая солея). Тело овальной формы. Оба глаза на правой стороне. Передняя ноздря глазной стороны в виде трубки, передняя ноздря слепой стороны расширена в виде розетки и расположена около задней ноздри. Рот конечный, изогнутый. Край преджаберной крышки скрыт
Таблица 23. Численность и средняя масса морского языка (носатой солеи) разных размерных групп в российской зоне Черного моря в период 1993-2016 гг.
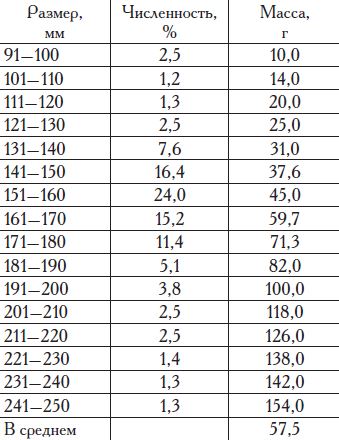
Таблица 24. Уловы икры и личинок морского языка (носатой солеи) в весенне-летний период 1993-2017 гг., шт/сеть
под кожей. Спинной плавник имеет 67-76 лучей, начало его на уровне верхнего глаза. Анальный плавник с 54-61 лучами. Грудные плавники на обеих сторонах состоят из семи лучей и хорошо развиты. Хвостовой плавник соединен с последним лучом спинного и анального плавников низкой мембраной. Боковая линия имеет 113-175 чешуй, прямая, ветвь выше виска слабоизогнутая. Чешуя ктеноидная. Окраска глазной стороны тела темно-коричневого цвета с многочисленны-
ми более или менее размытыми черноватыми пятнами. Грудной плавник глазной стороны имеет в середине темное пятно, не окруженное светлым кольцом. Слепая сторона белесая. Максимальный размер 25 см, обычно 10—16 см. Донный вид, обитает на песчаных грунтах в прибрежных водах.
В северо-восточной части Черного моря вид отмечался нами на двух участках от Анапы до Большого Утриша на глубинах 10—18 м и в районе Большого Сочи на глубинах 10—15 м, а три экземпляра были пойманы на глубине 35—37 м. За весь период наблюдений в российской зоне моря было отмечено всего 92 экземпляра данного вида.
В уловах встречались рыбы длиной 91—250 мм и массой от 10 до 154 г, преобладали особи размерами 141—180 мм и средней массой 37,6—71,3 г (табл. 23).
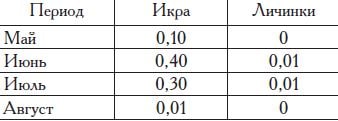
Впервые созревает при длине тела 100—110 мм. Нерест, судя по наличию икры в планктоне моря, начинается в мае—августе, а массовый нерест — в июне—июле (табл. 24).
Ранняя молодь до метаморфоза ведет пелагический образ жизни и разносится течениями на значительные расстояния. Так, в середине 1990-х гг. личинки морского языка в единичных экземплярах отмечались в уловах малькового трала на удалении от берега до 45—50 миль (до 100 км) над глубинами более 2000 м.
Питается живущими на дне или закапывающимися в грунт беспозвоночными, в основном полихетами (Polychaeta) — 45%, моллюсками (Mollusca) — 31% и мелкими донными ракообразными. Максимальная интенсивность питания отмечается в посленере-стовый период с сентября по начало ноября.
Вследствие редкой встречаемость оценить численность и биомассу данного вида не представляется возможным.
Арноглосса. Тело овальное. В спинном плавнике 72—77 лучей, в анальном — 51—57. Боковая линия развита только на глазной стороне, имеет изгиб над грудным плавником, содержит 38—42 чешуи. Глазная сторона коричневатая или серовато-желтая,
иногда с темными или черными пятнышками по всему телу. Максимальный размер — 72 мм. Донный вид континентального шельфа, встречается главным образом в прибрежье на глубинах до 20 м. Размножение с мая по август. Питается мелкой рыбой и беспозвоночными. В российской зоне Черного моря встречается на песчаных грунтах у берегов Крыма и Кавказа (Fischer et al., 1987; Васильева, 2007).
В уловах учетных орудий лова встречается редко. Длина колеблется в пределах 36—75 мм, в основном — 46—50 мм, масса 2,5—7,0 г, средняя — 4,7 г (табл. 25).
Размножение арноглоссы отмечается в мае—августе, пик его приходится на июль. По данным ихтиопланктонных съемок, проводимых в территориальных водах России в Черном море, икра ее облавливается в прибрежной зоне над глубинами 10—30 м. Максимальный улов икры отмечается в июле — 1—2 шт/ сеть, в среднем — 0,001 шт/сеть.
Редкие виды — гладкий ромб Scophthalmus rhombus и морской язык Pegusa lascaris - нами за период исследований в северо-восточной части Черного моря не отмечены, хотя данные о их присутствии в единичных экземплярах у побережья Крыма в литературе встречаются (Fischer et al.,
1987; Васильева, 2007).
ЗАКЛЮЧЕНИЕ
Представителями отряда камбалообразных в Азовском и Черном морях являются 11 видов — это арноглосса Кесслера Arnoglossus kessleri, европейская арноглос-са A. laterna, арноглосса-пелудилья A. thori Bothidae), глосса Platichtys luscus (Pleu-ronectidae), камбала-калкан Scophthalmus maeoticus, вероятно, с двумя подвидами, гладкий ромб S. rhombus (Scophthalmi-dae), желтая солея Buglossidium luteum, короткоперая солея Microchirus varitgatu, морской язык Pegusa lascaris; морской язык, или носатая солея, P. nasuta; европейская солея Solea solea (Soleidae). В наших иссле-
Таблица 25. Численность и средняя масса кам-балы-арноглоссы разных размерных групп в российской зоне Черного моря в период 1993 — 2017 гг.
Размер, мм Численность, % Масса, г
36-40 9,5 2,5
41-45 14,3 3,1
46-50 23,8 3,7
51-55 14,3 4,2
56-60 14,3 5,0
61-65 9,5 5,8
66-70 9,5 6,4
71-75 4,7 7,0
В среднем 4,7
дованиях отмечены пять видов и подвидов: камбала-калкан азовская и черноморская, камбала-глосса, морской язык (носатая солея), арноглосса. Остальные виды за период исследований не встречены.
Популяция камбалы-калкана в Азовском море насчитывает девять возрастных групп. Половой зрелости самцы достигают на 3-м, а самки на 3—6-м году жизни. Распреснение Азовского моря отрицательно сказалось на воспроизводстве камбалы. Интенсивная эксплуатация стада с конца 1990-х гг. привела к снижению численности производителей, в результате чего ежегодное пополнение популяции азовского калкана осуществляется крайне низкоурожайными поколениями. В настоящее время популяция находится в депрессивном состоянии.
В период с 1993 по 2017 гг. в российской части черноморского шельфа от Феодосийского залива до Геленджика на глубинах от 10 до 50 м нами отмечено более 140 экз. азовского калкана. Сравнение размерно-массового состава азовского и черноморского стад азовского калкана свидетельствует об отсутствии у них существенных различий.
Распределение черноморской камбалы-калкана вдоль северо-восточного побережья моря в значительной мере зависит от ширины шельфовой зоны. Максимально камбалы всех размерных групп отмечаются
на участках с широким шельфом - в Керченском предпроливье и запретном пространстве «Анапская банка», а минимально - на участке Туапсе-Адлер (Большое Сочи), где ширина шельфа наименьшая. Молодь камбалы предпочитает глубины до 50 м. Производители в период зимовки распределяются на глубинах более 50 м. Весной они мигрируют в мелководную часть шельфа на нерест, который проходит в основном на глубинах 36-50 м. После размножения и летне-осеннего нагула они отходят на глубины зимовки
(51-100 м).
Первые зрелые самцы калкана встречаются в возрасте двухгодовика, а самки в трехгодовалом возрасте. Массовое созревание поколения происходит в 3-4-годова-лом возрасте, а полное - в 6-7-годовалом. Массовый нерест в южной части Кавказского района проходит с конца марта-начала апреля до середины июня. На участке от Туапсе до Новороссийска массовое размножение происходит несколько позже, с середины апреля по конец июня. Самое позднее начало размножения отмечается в Керченско-Та-манском районе и у побережья Крыма: здесь массовый нерест проходит в мае-июне, и к началу июля он завершается. Продолжи -тельность массового нереста черноморского калкана составляет около двух месяцев. Икра и личинки калкана до фазы метаморфоза распределяются в поверхностных слоях воды в течение двух месяцев. В результате, если нерест проходил в глубоководной части шельфа, икра и ранняя молодь камбалы выносятся из шельфовой зоны в открытое море и могут быть перенесены на расстояние около 2000 км (более 900 миль). Вероятно, часть молоди к моменту перехода на донный образ жизни успевает оказаться над шельфом Турции. Максимальный темп линейного роста происходит у камбалы в первые три года жизни, а весового - в период первого полового созревания. С возрастом линейный рост замедляется и на 5-10-м годах жизни составляет 3-4 см в год, а у более старших возрастных групп - 1-2 см. Весовой темп роста после достижения половой зрелости
стабилизируется на уровне 500-700 г в год. До четырехлетнего возраста самцы и самки растут одинаково, в дальнейшем у самцов темп размерно-весового роста в отличие от самок замедляется в большей степени. Увеличение с 2000 г. сроков запрета на промысел калкана в период его массового размножения с 15 сут. до полутора месяцев способствовало свободному проходу производителей на традиционные нерестилища в мелководной части шельфа и появлению урожайных поколений.
Основным районом обитания камбалы-глоссы в Азовском море является восточная часть Сиваша. Здесь ее длина достигает 30 см при возрасте 5 лет. Созревает глосса в возрасте 3-5 лет. Массовый нерест в заливе Сиваш происходит с середины января до конца февраля. Оптимальной для нереста и нагула камбалы-глоссы является соленость воды в диапазоне 25-30%о, а при солености ниже 20 и выше 50-60%%о эффективность нереста резко снижается. В связи с прекращением сброса пресной воды в Сиваш соленость залива у берегов Крыма повысилась до 30-75%. Это дает некоторую надежду на улучшение условий воспроизводства камбалы-глоссы и частичное восстановление здесь ее запаса.
В Черном море глосса, благодаря своей эвригалинности, широко распространена по всем берегам моря и в соленых лиманах. От 70 до 80% популяции глоссы в российском территориальном море сосредоточено на участке шельфа от Новороссийска до Адлера. В холодное время года она распределяется относительно равномерно по всей ширине шельфа, а с началом весеннего прогрева водной толщи концентрируется в холодном слое воды под слоем термоклина. Половая зрелость наступает у самцов глоссы в возрасте четырех лет (3+), а у самок на год позже. Как и у всех холодолюбивых видов рыб, нерест глоссы проходит в холодное время года, в декабре-январе. Однако нерест отдельных особей может отмечаться и в мае на больших глубинах - 60-70 м. Соотношение полов в популяции характеризуется значительным
преобладанием самок: 70—75%. Возрастная структура насчитывает 10 групп. Сеголетки-годовики обитают в узкоприбрежной зоне и в уловах встречаются редко.
Носатая солея — редкий вид в ихтиофауне моря. В уловах в основном встречаются особи размером 141—180 мм и средней массой 37,6—71,3 г. Впервые созревает при длине тела 100—110 мм. Нерест, по уловам икры в планктоне моря, отмечается в мае— августе, а массовый нерест — в июне—июле.
Еще более редким видом является камбала-арноглосса. Исследованные экземпляры имели длину 36—75 мм, с преобладанием 46—50 мм. Размножение арноглоссы отмечается в мае—августе, пик его приходится на июль. Икра облавливается в прибрежной зоне над глубинами 10—30 м.
СПИСОК ЛИТЕРАТУРЫ
Бабаян В.К. Принципы рационального рыболовства и управление промысловыми запасами // Тез. докладов I конгресса ихтиологов России. М.: ВНИРО, 1997. С. 57-58.
Васильева Е.Д. Рыбы Черного моря. Определитель морских, солоноватоводных, эвригалинных и проходных видов с цветными иллюстрациями, собранными С.В. Богородским. М.: Изд-во ВНИРО, 2007. 238 с.
Васильева Е.Д., Лужняк ВА. Рыбы бассейнов Азовского моря. Ростов н/Д: изд-
во ЮНЦ РАН, 2013. 270 с.
Воробьёва Н.К., Гнатченко В.Ф., Талкина М.Г. Разработка биотехники искусственного разведения камбал (калкана и глоссы) и кефалей в Чёрном море. Отчёт о НИР. Керчь: АзЧерНИРО, 1976. 150 с.
Дехник Т.В. Ихтиопланктон Черного моря. Киев: Наук. думка, 1973. 236 с.
Емтыль М.Х., Иваненко А.М. Рыбы юго-запада России. Краснодар: Ку-бан. госун-т, 2002. 340 с.
Комарова Г.В. Промысловая ихтиология. Астрахань: Изд-во АГТУ, 2006. 192 с.
Майский В.Н. Об оценках запасов
азовской тюльки // Тр. ВНИРО. 1967. Вып. 5. С. 190-196.
Марти Ю.Ю. Материалы к биологии черноморской камбалы-калкан. М.:
Изд-во АН СССР, 1939. С. 37-45.
Методы рыбохозяйственных и природоохранных исследований в Азово-Черно-морском бассейне. Краснодар: АзНИИРХ,
2005. 352 с.
Надолинский В.П., Дахно В.Д., Кольвах С.А. Камбалы российских вод Черного моря // Основные проблемы рыбного хозяйства и охраны рыбохозяйственных водоёмов Азово-Черноморского бассейна. Ростов н/Д: АзНИИРХ, 1998. С. 161-167.
Назаров В.М., Чупурнова Л.В. Приспособительные особенности экологии размножения и полового цикла глоссы северо-западной части Черного моря и прилегающих лиманов / / Вопр. ихтиологии. 1969. № 6. С. 1133-1140.
Никольский Г.В. Частная ихтиология. М.: Высш. шк., 1971. 472 с.
Парин Н.В., Евсеенко СА, Васильева Е.Д. Рыбы морей России: аннотированный каталог. М.: Т-во науч. изд. КМК,
2014. 733 с.
Правдин И.Ф. Руководство по изучению рыб. М.: Пищ. пром-сть, 1966. 376 с.
Попова В.П. Распределение камбалы в Черном море // Тр. АзЧерНИРО. 1954. Т. XXVIII. С. 37-50.
Попова В.П. Некоторые закономерности динамики численности камбалы-кал-кан Чёрного моря / / Тр. ВНИРО. 1966. Вып. 24. С. 87-95.
Попова В.П., Винарик Т.В. Камбала-калкан // Сырьевые ресурсы Черного моря. М.: Пищ. пром-сть, 1979. С. 166175.
Промысловое описание Черного моря. М.: Глав. управл. навигации и океанографии МО СССР, 1988. 140 с.
Световидов А. Н. Рыбы Черного моря. М.; Л.: Наука, 1964. 552 с.
Серобаба И. И., Шляхов В. А. Прогноз возможного вылова основных промысловых рыб, беспозвоночных и водорослей
Черного моря на 1991 г. (с расчетом эффективности) // Комплексные исследования биоресурсов Мирового океана. Керчь: Аз-
ЧерНИРО, 1989. 210 с.
Состояние биологических ресурсов Черного и Азовского морей. Керчь: ЮгНИРО,
1995. 64 с.
Хоросанова А.К. Биология глоссы Ходжибеевского лимана // Зоол. журн.
1949. Т. XXVIII. Вып. 4. С. 351-354.
Чугунова Н.И. Руководство по изучению возраста и роста рыб. М.: Изд-во
АН СССР, 1959. 164 с.
ШишлоЛ.А. Современное состояние запасов черноморского калкана и перспекти-
вы его промысла / / Основные результаты комплексных исследований ЮгНИРО в Азово-Черноморском бассейне и Мировом океане. Керчь: ЮгНИРО, 1993. С. 84-89.
Fischer W., Bauchot M.-L., Schneider M. Méditerranée et mer Noire. Zone de pêche 37. V. II. Vertébrés. Rome: FAO, 1987. Р. 761-1530.
Zengin M., Duzgunes E. Variations on the turbot (Scophthalmus maeoticus) — tocks in the south-eastern Black sea during the last decade and comments on fisheries management // Workshop on demersal resources in the Black Sea and Azov Sea. Istanbul: Ed. Bayram Oz-türk and Saadet Karakulak, 2003. P. 5—10.
В.П. Надолинский, В.А. Шляхов, У.Н. Александрова
Азовский научно-исследовательский институт рыбного хозяйства, Ростов-на-Дону, 344002 E-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.