К методике культивирования живых кормов для объектов морской аквакультуры
В биотехнологическом процессе разведения некоторых морских рыб обязательным звеном является применение живых кормов. По ряду причин анатомо-физиологического и биохимического характера пищеварительной и ферментативной систем личинки морских рыб, перспективные для марикультуры (камбаловые, серановые, кефалевые), не могут употреблять инертные (искусственные) корма в течение первых 10-20 суток жизни. Они питаются только живыми фито и зоопланктонными организмами: микроводорослями, инфузориями, коловратками, веслоногими и ветвистоусыми ракообразными, а также личинками моллюсков, полихет, остракод, балянусов и артемий. Изучение пищевой ценности живых кормов показало, что они обладают необходимой питательной ценностью для роста и выживания рыб
[3, 26, 29, 30]. Поэтому, несмотря на современные успехи в создании стартовых искусственных кормов, зоопланктон остается обязательным элементом при разведении морских рыб, во всяком случае, для молоди раннего возраста. В связи с этим очень важно определить необходимый минимум употребления живых организмов и обеспечить их производство наиболее эффективными и экономичными способами. В настоящее время именно в таком аспекте ведется большая часть исследований на морских и пресноводных рыбопитомниках. Работы ведутся в трех направлениях: во-первых, по пути сокращения цепи питания «фитопланктон – зоопланктон – личинки рыб», во-вторых, в направлении более ранней замены живых кормов инертными кормами и, в-третьих, по обогащению всех видов кормов специальными ингредиентами для повышения их пищевой ценности. Приоритетной задачей современного рыбоводства является улучшение качества и снижение себестоимости выращенной
продукции за счет повышения качества живых и искусственных кормов с использованием в их составе нетрадиционных более дешевых составляющих, иммуномодуляторов и экологически безопасных ростостимулирующих веществ. В настоящее время, в условиях интенсивного ведения пресноводного и морского рыбоводства, различные химические, биологические и ферментные препараты, биоактивные вещества, микроэлементы, пробиотики, эубиотики находят применение во всех технологических процессах рыборазведения: получении потомства, повышении естественной кормовой базы, борьбе с нежелательными гидробионтами и паразитами и т. д. [1, 8, 24, 31, 32, 35]. Разработанные за последние десятилетия методы массового производства живых и искусственных кормов позволили перейти к искусственному рыборазведению на уровне индустриальной отрасли хозяйств в пресноводной аквакультуре (форелевые, осетровые, карповые) [9, 10, 24, 33]. Однако разведение морских рыб еще не достигло крупных масштабов [6, 29, 31].
Если культивированных коловраток (класс Monogononta) и артемий (класс Branchiopoda) довольно широко используют для кормления рыб, то выращивание морских веслоногих ракообразных копепод (подкласс Copepoda), наиболее излюбленных объектов питания личинок морских рыб, до настоящего времени остается малоосвоенным, что объясняется многими причинно-следственными явлениями. Также не встречается описание эффективных способов массового выращивания морских инфузорий (класс Ciliata) – стартового корма. При современных крупномасштабных работах для удовлетворения пищевых потребностей морских рыб используют в основном природный зоопланктон или способы экстенсивного культивирования кормовых организмов [7, 27, 31]. Проблема разработки эффективных способов массового культивирования живых кормов в морской воде для объектов аквакультуры является одной из актуальных в рыбохозяйственной науке, решение которой важно для развития марикультуры в России.
В мировой практике в процессе разработки технологий промышленного выращивания зоопланктона было установлено, что температурный оптимум для культивирования многих видов кормовых беспозвоночных организмов находится в диапазоне 20-25 °С [2, 4]. Вместе с тем при проведении работ с рыбами, нерестящимися ранней весной и поздней осенью, в ЮгНИРО возникла необходимость разработки методов культивирования зоопланктона в условиях неоптимального режима температуры. Были проведены специальные исследования по подбору ингредиентов для питательных кормовых смесей; таких эвритермных видов беспозвоночных организмов, которые бы обладали наибольшими продукционными возможностями, а также по определению границ интервала солености, при которых возможно осуществлять массовое выращивание морского и солоноватоводного зоопланктона. Результаты полученных данных легли в основу разработки ДСТУ, патентов, инструкций, а также подготовки рекомендаций и статей [11, 12, 15-17].
МАТЕРИАЛЫ И МЕТОДИКА
Научно-исследовательские работы по массовому культивированию зоопланктона проводились на экспериментальной базе ЮгНИРО НИБ «Заветное» (Керченский пролив) в 1985-1989 и 20062014 гг.; на Таманском рыбопитомнике (Краснодарский край) в 1995-1996 гг.; на Одесском рыбопитомнике – ХТМО (Шаболатский лиман, Черное море) в 1997-2000 и 2008 гг.
В работе представлены некоторые результаты, полученные при культивировании следующих видов зоопланктона: инфузории Euplotes affinis Dujardin, 1842; E. charon O.F. Muller, 1786; Mesodinium pulex Claparede et Lachman, 1858; коловратки Brachionus plicatilis plicatilis O.F. Muller, 1786; кладоцеры Diaphanosoma brachiurum Levin, 1848; копеподы Diaptomus salinus E. Daday, 1885; D. gracilis Sars, 1862; Acartia clausi Giesbrecht, 1889; Calanipeda aquae dulcis Kriczagin, 1873; Tisbe furcata Baird, 1837.
Культуры зоопланктеров выделяли из солоноватоводных водоемов, расположенных вдоль побережья Керченского пролива, Черного и Азовского морей.
Для культивирования применялись различные емкости: рыбоводные лотки объемом 1,5 м3, стеклопластиковые емкости объемом от 100 л до 6 м3, бетонные бассейны (80-200 м3) и солоноватоводные земляные пруды площадью 0,01-0,05 га. Выращивание проходило под навесом и на открытом
пространстве, в условиях окружающей среды. Емкости и бассейны имели естественное освещение днем и искусственное ночью (галогеновые или люменисцентные лампы мощностью до 300 ватт). Бетонные бассейны выстилались специальной полихлорвиниловой пленкой черного цвета или пробеливались хлорной известью. Пластиковые и стеклянные емкости перед началом работ обрабатывались раствором фуразолидона (0,5 мг/л).
Для поддержания кислородного режима применяли аквариумные и стационарные компрессоры и пластиковые распылители. Барботаж культуральной среды сжатым воздухом осуществлялся в бассейнах и емкостях круглосуточно. Каждые 4-7 суток третью часть культуральной среды заменяли на свежую морскую воду и проводили очистку дна с помощью сифонов. В другом случае выращивание проходило при слабой проточности: суточный оборот с 1 м3 культуральной среды составлял не более 20 л. Сбор зоопланктона и камеральную обработку проб производили по стандартным методикам [18, 22]. Экспериментальные работы по определению удельной продукции, отношению к солености, скорости и стадиям размножения проходили в помещениях. Удельная продукция протистов определялась по скорости их размножения [4], сырая биомасса организмов – методом прямого взвешивания.
На дно бассейнов и емкостей перед залитием их морской водой помещали кораллово-ракушечные фракции в количестве 6-8 кг/м2. Кормом для организмов служили питательные смеси. Их использование начинали за 10-30 суток до внесения маточной культуры выращиваемых организмов. День внесения маточной культуры зоопланктеров считается первыми сутками выращивания.
Культивирование зоопланктона проходило накопительным (культивирование партиями) и полунепрерывным способами. С 6-8 суток выращивания производилось ежедневное изъятие сырой биомассы зоопланктеров для кормления личинок кефалевых и камбаловых рыб.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Основным этапом исследований при культивировании инфузорий и коловраток было сравнение влияния питательных смесей различного состава и пекарских дрожжей на рост популяций при неоптимальном режиме температуры выращивания.
Определяли основные параметры выращивания инфузорий родов Euplotes и Mesodinium: удельную продукцию, время генерации, число делений в сутки при неблагоприятном режиме температуры (8-16 °С).
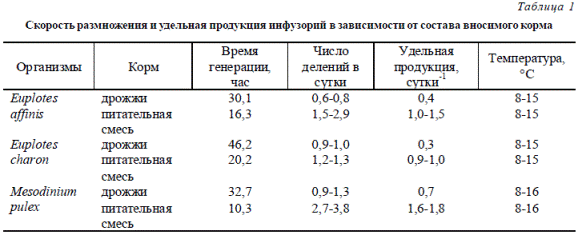
В табл. 1 представлены данные об интенсивности размножения инфузорий в зависимости от состава вносимого корма при неоптимальном режиме температуры.
По показателям в табл. 1 можно проследить, что скорость размножения и удельная продукция в опытах, когда кормом для протистов служила питательная смесь, почти в два раза больше, чем в контрольных емкостях, где кормом были «чистые» пекарские дрожжи. Удельная продукция для p. Euplotes составляла 0,9-1,5 сут.-1 при температуре 8-15 °С, а для p. Mesodinium – 1,6-1,8 сут.-1
Организмы Корм
Таблица 1 Скорость размножения и удельная продукция инфузорий в зависимости от состава вносимого корма
(8-16 °С), соответственно. Значения удельной продукции для инфузорий, близких к изученным размерным группам, по данным других авторов, равны 0,4-2,8 сут.-1 при температуре культуральной среды от 23 до 25 °С [4].
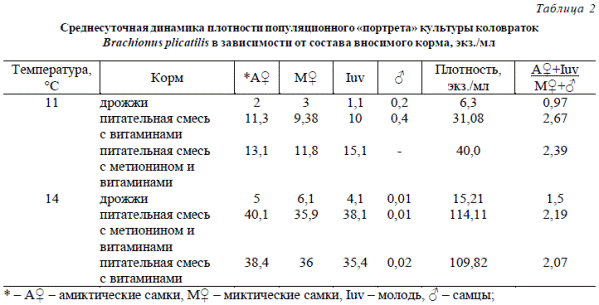
В табл. 2 приведены некоторые результаты исследований по среднесуточному изменению плотности популяционного «портрета» культуры коловраток в зависимости от состава вносимого корма при низкой температуре культуральной среды (11-14 °С). Продолжительность культивирования – 25 суток.
Температура, °С
В табл. 2 показано, что в емкостях, где в качестве корма для коловраток применялась питательная смесь, популяция Br. plicatilis была более «здоровой», поскольку соотношение суммы амиктических самок и молоди к сумме миктических самок и самцов (показатель «здоровой» популяции коловраток) было больше и составляло 2,07-2,67, а в емкостях, где кормом были пекарские дрожжи, – 0,97-1,5. Максимальная плотность коловраток была, соответственно, 114,11 и 15,21 экз./мл.
Полученные данные позволили предположить, что при массовом культивировании коловратки Br. plicatilis и инфузорий родов Euplotes и Mesodinium в условиях неоптимального режима температуры целесообразно применять питательные смеси, используемые для их кормления, что делает возможным получение большей численности организмов, чем применение в качестве корма дрожжей (табл. 1, 2).
Одним из этапов работ по освоению массового культивирования веслоногих рачков стали эксперименты по определению наиболее продуктивных видов и возможности их выращивания при солености культуральной среды от 12 до 20 ‰.
В начале исследований определяли влияние перепадов градиентов солености на выживание и способность копепод к размножению.
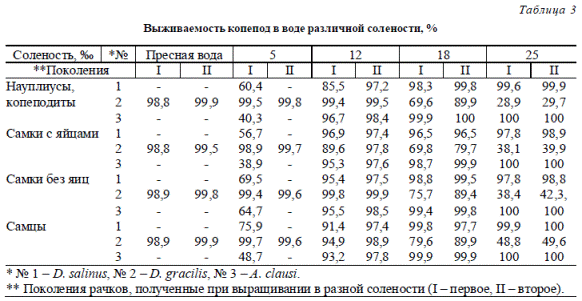
В табл. 3 приводятся данные экспериментальных работ по выживанию (%) веслоногих ракообразных A. clausi, D. salinus и D. gracilis в воде различной солености. Продолжительность опытов составила 78 суток.
Из табл. 3 становится очевидным, что наиболее эвригалинным видом по отношению к диапазону солености 0-18 ‰ является рачок No 2 – D. gracilis. Рачки No 1 (D. salinus) и No 3 (A. clausi) выживали в пресной воде не дольше 15 часов, а в воде с соленостью 5 ‰ из их первых поколений выжило 40-75 %, второго поколения получить не удалось.
Таблица 2 Среднесуточная динамика плотности популяционного «портрета» культуры коловраток Brachionus plicatilis в зависимости от состава вносимого корма, экз./мл
* – А+ – амиктические самки, М+ – миктические самки, Iuv – молодь, > – самцы; А++ Iuv М++> – формула «здоровой» популяции коловраток (соотношение суммы амиктических самок и молоди к сумме миктических самок и самцов) [5].
Таблица 3 Выживаемость копепод в воде различной солености, %
Наиболее благоприятным диапазоном солености для копепод No 1 (D. salinus) был ряд: 12, 18, 25 ‰. Полученные результаты согласуются с данными А.М. Семика о том, что рачок D. salinus – типичный эврибионтный вид, выдерживающий перепады солености от 5 до 40 ‰ [21]. Рачки A. clausi лучше выживали в солености 18 и 25 ‰, но и в воде с соленостью 12 ‰ их выживаемость в первом поколении была более 94 %, а во втором – более 97 %. В солености 25 ‰ меньше всего выживали копеподы D. gracilis.
Таким образом, все три вида рачков можно культивировать в морской воде с градиентом солености от 12 до 20 ‰.
На следующем этапе исследований определяли, какой из рачков имеет наименьший период инкубационного развития (с момента оплодотворения до вылупления яиц) и наибольший период науплиального развития (с момента появления рачков до первой копеподитной стадии). Первый период обуславливает скорость размножения, а второй важен с той точки зрения, что на ранних этапах экзогенного питания личинки морских рыб предпочитают питаться младшими возрастными формами веслоногих ракообразных (науплиусами).
На рис. 1 показаны некоторые данные по размножению копепод A. clausi, D. salinus и T. furcata в воде с различной соленостью. Температура культуральной среды за период исследований изменялась от 14 до 22 °С. Продолжительность экспериментов составила 72 сут. Кормом служили питательные смеси.
Полученные результаты о состоянии популяции копепод на разных этапах их жизненного цикла в воде с соленостью 12 и 18 ‰ позволяют утверждать, что наиболее перспективными видами копепод для массового культивирования являются рачки A. clausi и D. salinus. Длительность их инкубационного периода составляет 1-2,5 сут., у рачка T. furcata, соответственно, – 1,5-3,5 сут. Науплиальные периоды рачков тоже достаточно длительные – от 6 до 10 сут., а у рачка T. furcata – 3,5-4 сут. (рис. 1). Из литературных источников известно, что длительность развития науплиусов определяется экологическими условиями, продолжительность может составлять от одной недели до нескольких месяцев [20]. По количеству отложенных яиц рачки отряда каланоида тоже более плодовиты, чем гарпактикоиды. У рачка A. clausi самки откладывают до 22 шт. яиц, а у вида D. salinus носят в яйцевом мешке от 13 до 15 шт. яиц. Индивидуальная плодовитость в течение двух месяцев (июньиюль): у D. salinus она составила 80-100 шт. яиц, у A. clausi – 100-140. У рачка T. furcata самки носят до 14 яиц, индивидуальная плодовитость составила 90 шт. (рис. 1).
Изучение продукционных возможностей веслоногих ракообразных показало, что интенсивность размножения копепод определяется не только абиотическими факторами, но и биотическими, основной из них – уровень пищевой обеспеченности рачков [19]. Поэтому следующим этапом работ было определение влияния трофического фактора (обильное и ограниченное кормление питательными смесями) на длительность развития копепод. Выбор значений температуры обусловлен тем, что именно такую среднюю температуру можно наблюдать чаще всего при культивировании в бассейнах большого объема и прудах. Продолжительность экспериментов – 35 суток.
На рис. 2 приведены показатели по размножению копепод (D. gracilis, C. aquae dulcis), полученные при варианте обильного кормления.
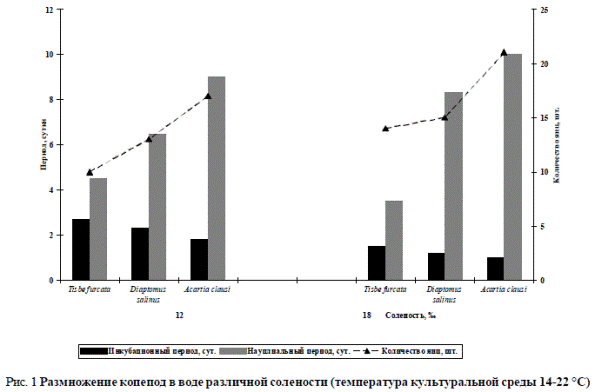
Рис. 1 Размножение копепод в воде различной солености (температура культуральной среды 14-22 °С)
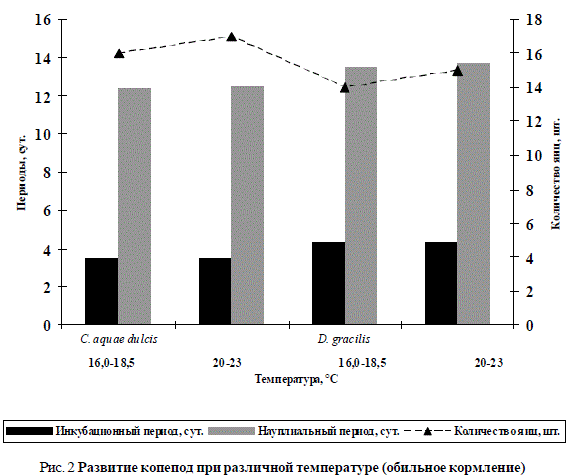
Рис. 2 Развитие копепод при различной температуре (обильное кормление)
Из рис. 2 видно, что в случае обильного кормления, по сравнению со вторым вариантом (ограниченное кормление), от самок рачков получили большее количество отложенных яиц и меньший инкубационный период развития. Причем в случае обильного кормления результаты несколько отличались по отношению к температуре. При температуре 20-23 °С все показатели были выше.
Исследователь Л.И. Сажина отмечает, что у A. tonsa, обитающей в водах Африканского шельфа, развитие кладок завершается за 10-12 ч при температуре 15 °С, а в менее продуктивном районе (воды Бенгельского течения) развитие кладок занимает 12-14 ч, несмотря на более высокую температуру (24 °С). Сопоставление величин кладок с температурой в пределах веслоногих ракообразных также показало отсутствие связи между ними, а сравнение величин кладок с первичной продукцией (развитием фитопланктона) выявило наличие прямой зависимости [19].
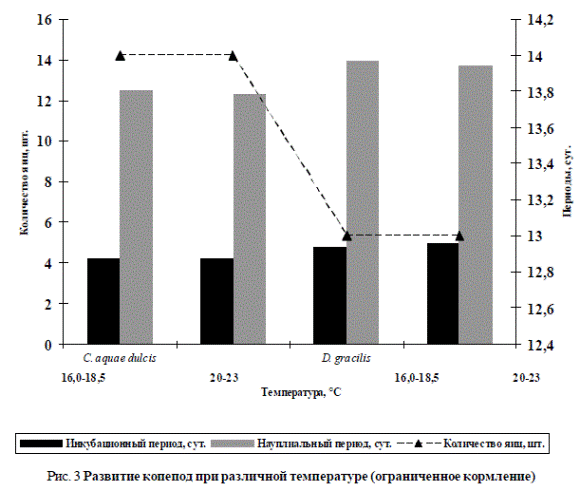
Следовательно, температура как фактор имеет значение, но достаточное количество определенного корма все же играет более существенную роль для размножения копепод. Это утверждение хорошо демонстрирует рис. 3.
Рис. 3 Развитие копепод при различной температуре (ограниченное кормление)
На рис. 3 показаны результаты эксперимента по размножению рачков в случае ограниченного кормления.
При ограниченном внесении смеси (рис. 3) все показатели были почти на одном уровне. Они в меньшей степени зависели от температуры. Однако температуру как параметр, влияющий на скорость размножения копепод, совсем исключать нельзя, потому что благоприятный температурный режим способствует интенсивному развитию бактерий и протистов, которые служат источником питания для копепод (рис. 4, 5).
В период проведения институтом работ с гребневиком при содержании его в искусственных условиях зимой возникла необходимость разработки методов культивирования зоопланктона в условиях аквариальной ЮгНИРО в небольших по объему емкостях (100 л).
Было исследовано наращивание количества сырой биомассы веслоногих рачков D. salinus в условиях неоптимальной температуры (14,5-17,5 °С) и при «обильном и ограниченном кормлении»
Продолжительность выращивания, сутки
питательными смесями. Значимость этого эксперимента состояла в том, что при культивировании рачки в качестве корма могли потреблять только питательную смесь и простейшие организмы, которые образовывались в результате ее внесения.
Для сбора рачков с каждого бассейна (10 шт.) процеживали по 9 л культуральной среды: всего ежедневно получали сырую биомассу рачков с объема 90 л культуральной среды. В продолжение всего эксперимента количество фитопланктона в ней не превышало 0,008-0,01 млн. кл./л. Питательные смеси вносились за 20 суток до начала первого изъятия сырой биомассы рачков. Продолжительность выращивания составила 27 суток.
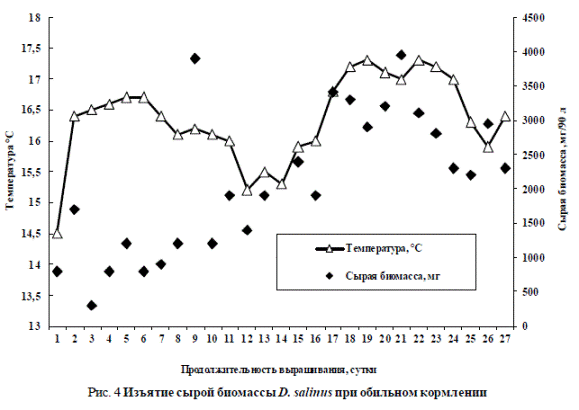
На рис. 4 показан отбор сырой биомассы рачков при «обильном кормлении», а на рис. 5 – изъятие сырой биомассы D. salinus при «ограниченном кормлении» рачков.
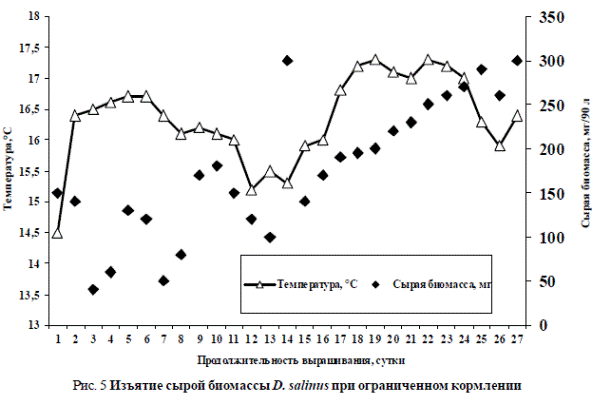
Рис. 5 Изъятие сырой биомассы D. salinus при ограниченном кормлении
По рис. 4 и 5 прослеживается, что сырую биомассу рачков в бассейнах начали изымать, когда ее значения достигли 800 мг/90 л при обильном кормлении и 150 мг/90 л – при ограниченном. Изъятие сырой биомассы рачков в бассейнах с обильным внесением питательной смеси было на порядок выше, чем в бассейнах с ограниченным добавлением. Численность рачков в опытных бассейнах поддерживалась на достаточно высоком уровне. Максимальные и минимальные значения изымаемой биомассы рачков в опытных и контрольных бассейнах были следующие: в опытных – 4000 и 250 мг/90 л; в контрольных – 310 и 40 мг/90 л, соответственно. Причем наращивание биомассы рачков всегда было связано с увеличением температуры, однако пищевой фактор выполнял более существенную роль.
Таким образом, проведенные эксперименты показали, что применяемые смеси могут служить источником питания для копепод при минимальных количествах фитопланктона.
При выращивании морских и солоноватоводных форм кладоцер используют те же методы выращивания, что и для пресноводных рачков. В настоящее время исследователи стараются упростить методы культивирования кладоцер, найти более дешевые способы, которые удобно применять для промышленного разведения [28, 34]. Поэтому при культивировании ветвистоусых ракообразных акцентировались на выращивании кладоцер в морской воде с применением питательных смесей в качестве корма для получения наибольшей численности рачков.
На рис. 6 приводятся данные по динамике плотности кладоцер и фитопланктона. Объем культуральной среды составлял 80 м3. В качестве корма для рачков использовали питательные смеси. Продолжительность культивирования – 60 суток.
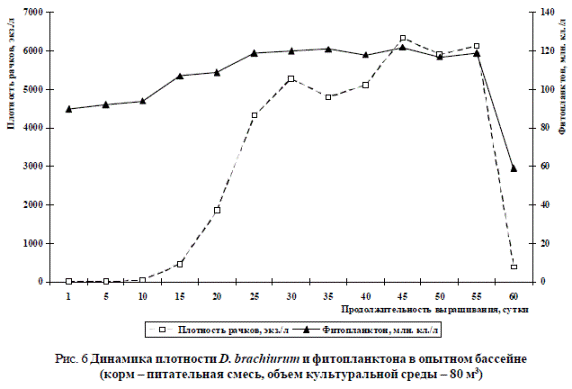
Рис. 6 Динамика плотности D. brachiurum и фитопланктона в опытном бассейне (корм – питательная смесь, объем культуральной среды – 80 м3)
По рис. 6 можно наблюдать, что на 10-е сутки выращивания плотность рачков составляла всего 45 экз./л. Численность начала резко увеличиваться с 15-х суток (после 12-кратного внесения смесей), к 20-м суткам она была 1850 экз./л, а на 30-е сутки плотность уже составляла 5285 экз./л. После уменьшения количества вносимой смеси (25 сут.) плотность кладоцер снизилась, затем снова восстановилась. Однако после того, как на 50-е сутки прекратили добавлять смеси, численность рачков резко уменьшилась (60-е сутки). Плотность микроводорослей к началу массового культивирования увеличилась с 13 (после 8-кратного внесения смеси) до 92 млн. кл./л. В остальной период выращивания D. brachiurum плотность микроводорослей в опытном бассейне составляла 100122 млн. кл./л. Культуральная среда на протяжении всего периода внесения питательных смесей
имела интенсивный зеленый цвет. При прекращении добавления смеси (50-е сутки) численность фитопланктона сократилась до 57 млн. кл./л к 60-м суткам. Культуральная среда приняла буроватозеленоватый оттенок.
На рис. 7 показаны данные по изменению численности рачков, полученные в бассейне, где в качестве корма для кладоцер использовали только кормовые дрожжи и комбикорм для рыб. Продолжительность культивирования – 60 суток.
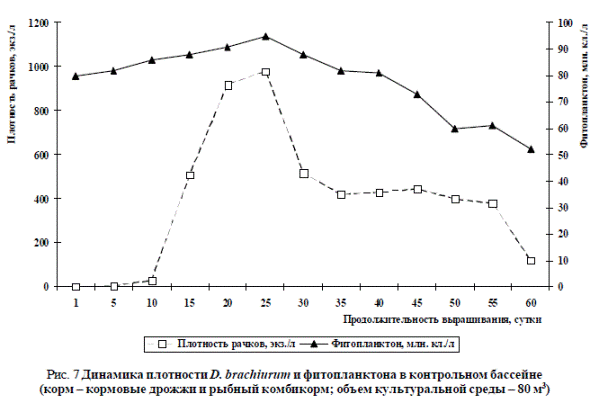
Рис. 7 Динамика плотности D. brachiurum и фитопланктона в контрольном бассейне (корм – кормовые дрожжи и рыбный комбикорм; объем культуральной среды – 80 м3)
На рис. 7 видно, что плотность микроводорослей к началу массового культивирования увеличилась с 13 до 80 млн. кл./л. На 25-е сутки выращивания количество микроводорослей увеличилось до 95 млн. кл./л. После уменьшения количества вносимого корма (25 сут.) плотность фитопланктона и рачков постоянно уменьшалась. Если в опытном бассейне численность кладоцер на 20-е сутки составляла около 2000 экз./л, а максимальная плотность рачков была 6340 экз./л (рис. 6), то во втором (контрольном) бассейне максимальная плотность рачков достигла 980 экз./л только на 25-е сутки культивирования (рис. 7). Следовательно, можно утверждать, что питательные смеси способствуют более быстрому процессу наращивания численности кладоцер, чем кормовые дрожжи.
Разработанные и используемые в производстве методы массового культивирования инфузорий, коловраток и кладоцер рассчитаны на выращивание одного продуктивного вида. Известно, что совместное культивирование животных одного трофического уровня возможно в том случае, когда спектры их питания расходятся и они используют разные кормовые ресурсы; если кормовые ресурсы схожие, гидробионты должны занимать разные экологические ниши обитания [23]. По данным некоторых исследователей, коловраток и ветвистоусых ракообразных возможно выращивать в поликультуре на питательных средах на основе органических удобрений или растительной органики с добавлением различных микроэлементов и биоактивных веществ (витаминов, аминокислот и т. д.) [25]. Наиболее важными объектами поликультуры после инфузорий и коловраток, по мнению авторов представляемой работы, служат веслоногие и ветвистоусые ракообразные, которые являются излюбленным кормом личинок камбаловых и кефалевых рыб Черноморского региона [13, 14]. В работе представлены некоторые результаты по культивированию двух видов рачков в поликультуре, проведенному в солоноватоводных прудах площадью 0,01 га. Контролем служил пруд, в который не вносилась питательная смесь, а пищей для планктеров служили кормовые дрожжи. Популяция веслоногих рачков D. salinus в прудах была аборигенной, плотность рачков до внесения
питательной смеси составляла 3-4 экз./л., численность фитопланктона – 0,2 млн. кл./л. Плотность вносимой маточной культуры ветвистоусых рачков D. drachiurum была 2300 экз./л, всего внесли 500 л маточной культуры. Продолжительность выращивания – 45 суток. Температура культуральной среды изменялась от 13 до 18,7 °С.
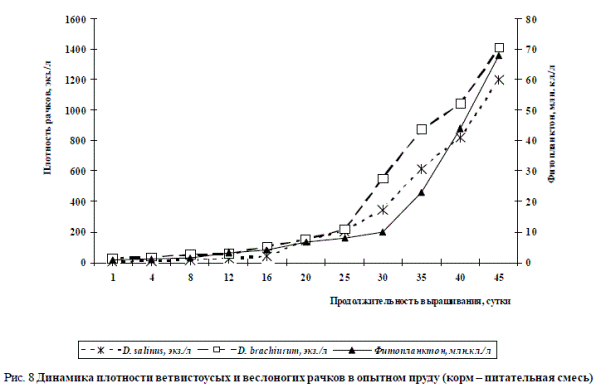
На рис. 8 приводятся параметры изменения плотности рачков, полученные в опытном пруду. Кормом служили питательные смеси.
Рис. 8 Динамика плотности ветвистоусых и веслоногих рачков в опытном пруду (корм – питательная смесь)
После 8-кратного внесения питательной смеси за первые сутки выращивания количество микроводорослей увеличилось до 0,8 млн. кл./л, плотность рачков D. salinus возросла незначительно – до 12 экз./л. Далее, как можно проследить по рис. 8, плотность фитопланктона и рачков в начале культивирования увеличивалась медленно. Скорее всего, это объясняется тем, что температура культуральной среды изменялась за период с 1-х по 16-е сутки всего от 13,0 до 15,7 °С. К 16-м суткам выращивания численность водорослей составляла 4 млн. кл./л, кладоцер – 104 экз./л, копепод – 42 экз./л. На 20-е сутки культивирования температура водной среды в пруду увеличилась до 16 °С, плотность фитопланктона – до 6,7 млн. кл./л, ветвистоусых рачков – до 152 экз./л, веслоногих – до 147 экз./л. К 30-м суткам культивирования, после того, как режим температуры достиг 17,5 °С, а численность микроводорослей составила 10 млн. кл./л, популяции рачков тоже начали быстро наращивать свою численность. За период с 30-х по 45-е сутки количество кладоцер увеличилось от 550 до 1412 экз./л, каланоид – от 346 до 1200 экз./л. Плотность фитопланктона на 45-е сутки культивирования составляла уже 68 млн. кл./л при температуре культуральной среды 18,7 °С.
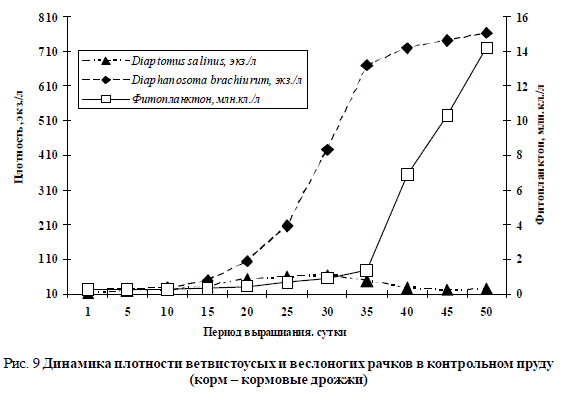
На рис. 9 представлены данные по динамике численности рачков, полученные в контрольном пруду, где в качестве корма для организмов применялись только кормовые дрожжи.
В контрольном пруду количество микроводорослей нарастало очень медленно: с 1-х по 45-е сутки выращивания оно изменилось от 0,25 до 14,2 млн. кл./л. Выше значения 14,2 млн. кл./л плотность микроводорослей уже не увеличилась. Плотность ветвистоусых рачков с 1-х по 45-е сутки культивирования увеличилась от 21 до 762 экз./л. Численность веслоногих рачков с 1-х по 25-е сутки возросла всего от 10 до 63 экз./л, а в период с 25-х по 45-е сутки плотность копепод D. salinus снизилась до 24 экз./л (рис. 9).
Следовательно, можно говорить о том, что в контрольном пруду популяции кладоцер и копепод находились в конкурентных пищевых отношениях. По-видимому, выращивание в поликультуре веслоногих рачков вида D. salinus и ветвистоусых рачков вида D. brachiurum возможно только при наличии определенного качественного и количественного состава фитопланктона, который развивается после внесения питательной смеси даже при неоптимальном режиме температуры.
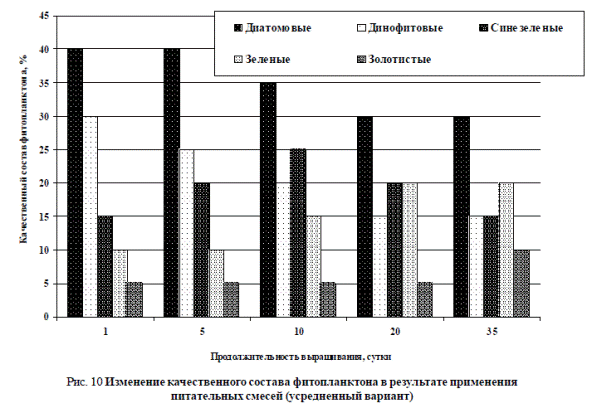
На рис. 10 приводится усредненный вариант развития качественного состава фитопланктона после внесения питательных смесей при использовании морской воды из Керченского пролива.
Рис. 9 Динамика плотности ветвистоусых и веслоногих рачков в контрольном пруду (корм – кормовые дрожжи)
Рис. 10 Изменение качественного состава фитопланктона в результате применения питательных смесей (усредненный вариант)
По рис. 10 можно наблюдать, что в первые сутки внесения питательных смесей морская вода обычно имеет светло-бурый цвет. В фитопланктоне по качественному составу преобладают диатомовые, синезеленые и динофитовые микроводоросли. В процентном отношении: до 40-45 % – диатомовые водоросли, до 30 % – синезеленые, около 15 % составляют динофитовые водоросли, 10 % – зеленые, 5 % – золотистые микроводоросли. После 5-7-кратного внесения питательных смесей (20-30 сут.) вода в бассейнах или прудах приобретает светло-зеленый цвет. Происходит изменение качественного состава: по 30 % приходится на диатомовые и динофитовые водоросли, 20 % – на зеленые, 15 % составляют синезеленые водоросли. До 10 % от общего количества микроводорослей могут развиваться золотистые водоросли. Примерно такой же состав водорослей остается в течение всего дальнейшего периода культивирования. При последующем внесении питательных смесей (на 40-50 сут.) количество зеленых и динофитовых водорослей может достигать 80-90 % от общего состава фитопланктона.
При применении питательных смесей за 20 суток до внесения маточной культуры культуральная среда всегда принимала четкий светло-зеленый оттенок, в отличие от первоначального бурого цвета. По видовому составу в начале культивирования обычно преобладают следующие виды водорослей: Bacillariophyta – Leptocylindricus minimum, Rhizosolenia calcar-avis, Nitzschia delicatissima, N. tenuirostris, Syrirella ovata, Coscinodiscus scutellum, C. radiatum, Chaetoceros curvisetus, Thalassionema nitzschioides; Dinophyta – Prorocentrum micans, Ceratium furca. В достаточно большом количестве могут присутствовать синезеленые водоросли Cyanophyta, это виды родов Lyngbya и Microcystis. После 10-12-кратного внесения смесей ведущими видами водорослей могут быть: Bacillariophyta – Pseudosolenia calcar-avis, Sceletonema costatum, Cyclotella caspia, Chaetoceros curvisetus, Cocconeis scutellum, Coscinodiscus scutellum; Dinophyta – Ceratium bergonii, Prorocentrum micans, Exuviaella cordata, Gymnodinium wulfii, Glenodinium sp., Girodinium sp.; Chlorophycophyta – Monoraphidium contorum, Binuclearia sp., Dunaliella viridis, Chlorella sp., Chlamydomonas sp., Platymonas sp., Scenedesmus sp., синезеленые водоросли родов Microcystis и Aphanizomenon. До 510 % от общего количества микроводорослей могут развиваться золотистые водоросли, с преобладанием вида Emiliania huxleyi. Можно предположить, что применяемые смеси могут служить хорошей питательной средой для развития фитопланктона.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
На основании многолетних результатов, полученных при культивировании зоопланктона, приводятся рекомендации по массовому культивированию зоопланктона в морской воде.
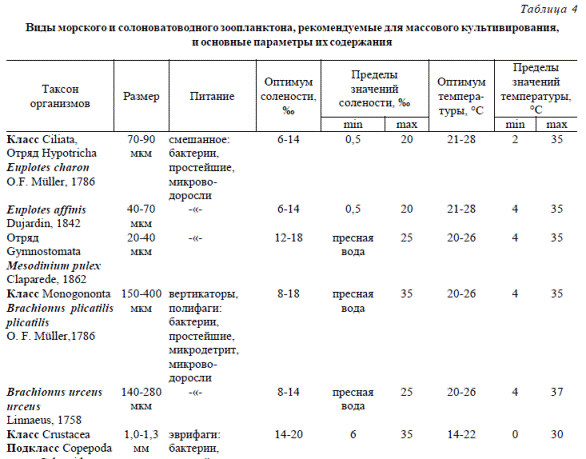
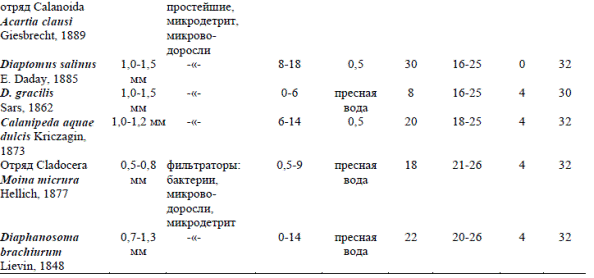
В табл. 4 представлены виды зоопланктона, рекомендуемые для выращивания, и основные гидрохимические параметры для их содержания.
В табл. 4 приведены основные параметры для культивирования и основные биолого-экологические характеристики трех видов ресничных инфузорий – E. charon, E. affinis, M. pulex; двух видов коловраток – Br. plicatilis, Br. urceus; двух видов ветвистоусых рачков – D. brachiurum, M. micrura и четырех видов веслоногих ракообразных – A. clausi, D. salinus, D. gracilis, C. aquae dulcis. В таблице также приводится: таксон организмов – 1, размер – 2, тип питания – 3, оптимум солености, при которой следует проводить культивирование, – 4, предельно допустимые значения колебания солености – 5, оптимальный режим температуры выращивания – 6, а также предельные значения температур, при которых данный вид может выживать, – 7.
Все перечисленные в табл. 4 виды гидробионтов обладают определенными биологическими свойствами, удовлетворяющими требованиям к объектам для промышленного выращивания: эврибионтность, эвритермность, эвригалинность; высокая продукционная способность; устойчивое развитие популяции в условиях высокой плотности; достаточная пищевая ценность; доступность для личинок и молоди морских рыб.
Промышленное культивирование зоопланктонных организмов можно проводить в закрытых помещениях, либо на площадках под навесами, либо в природных водоемах и прудах. Освещение в помещениях должно быть в диапазоне от 2000 до 8000 люкс. При выращивании маточных культур
Таблица 4 Виды морского и солоноватоводного зоопланктона, рекомендуемые для массового культивирования, и основные параметры их содержания
организмов освещение должно быть круглосуточным. Маточные культуры «разгоняются» в емкостях объемом не более 100-500 л.
Все емкости, которые используются для культивирования гидробионтов, рекомендуется обрабатывать дезинфицирующими веществами.
В табл. 5 приводятся рекомендуемые интервалы гидрохимических показателей культуральной среды при выращивании инфузорий, коловраток, копепод и кладоцер.
Контроль за изменением основных гидрохимических показателей (температура, содержание растворенного в воде кислорода) рекомендуется проводить ежедневно.
В табл. 5 представлены следующие гидрохимические параметры водной среды: температура – °С; содержание растворенного в воде кислорода – мг/л; водородный показатель – рН; содержание общего аммонийного азота – мкг·ат./л; содержание нитритного азота – мкг·ат./л; содержание нитратного азота – мкг·ат./л.
Численность организмов маточной культуры при внесении для дальнейшего промышленного культивирования организмов должна составлять: у инфузорий – от 5 до 10 экз./мл; у коловраток – не менее 0,5-1 экз./мл; у веслоногих и ветвистоусых рачков – 0,05-0,1 экз./мл. На 1 м3 культуральной среды, предварительно обогащенной питательными смесями, рекомендуется вносить не менее 2-3 л маточной культуры.
Для создания культуральной среды, в которой будет проходить выращивание организмов, рекомендуется применять различные ингредиенты.
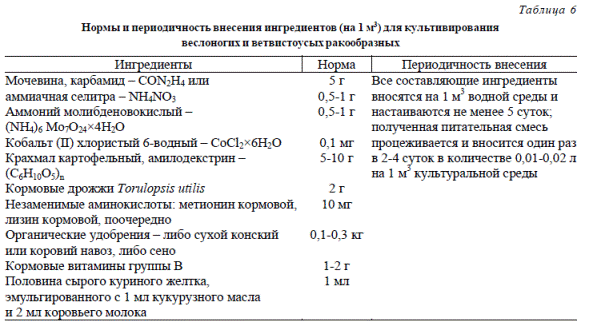
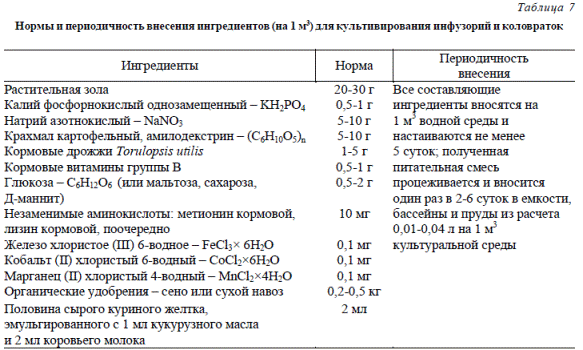
В табл. 6 и 7 приведены нормы и периодичность внесения ингредиентов для промышленного культивирования зоопланктона в бассейнах объемом от 2 до 250 м3 и прудах площадью не более 0,05 га.
Таблица 6 Нормы и периодичность внесения ингредиентов (на 1 м3) для культивирования веслоногих и ветвистоусых ракообразных
Ингредиенты Норма Периодичность внесения Мочевина, карбамид – CON
2
Таблица 5 Средние гидрохимические показатели водной среды, рекомендуемые для массового культивирования морского и солоноватоводного зоопланктона
Примечание 1: по достижении температуры культуральной среды выше 20 °С нормативы внесения ингредиентов питательной смеси рекомендуется уменьшать в 1,5-2 раза. Примечание 2: по достижении численности рачков более 10000 экз./л нормативы внесения ингредиентов рекомендуется увеличивать в 1,5-2 раза. Примечание 3: питательная смесь вносится за 15-30 суток до внесения маточной культуры. Примечание 4: для культивирования копепод рекомендуется использовать емкости с проточной водой объемом не менее 2-4 м3 с суточным оборотом воды до 40-80 л.
Химические ингредиенты и неорганические удобрения перед внесением в морскую воду необходимо предварительно растворять в небольших количествах пресной воды. Органические удобрения рекомендуется добавлять в специальных сетчатых мешочках, подвешенных в емкости. Кормовые дрожжи предварительно замачиваются в пресной воде. Внесение питательных смесей в пруды можно производить в наиболее удобные зоны либо осуществлять культивирование зоопланктона в специальных временно устанавливаемых садках.
Каждые 5 суток рекомендуется контролировать численность культивируемых организмов. Изменение плотности зоопланктона легко прослеживается визуально (косвенным методом) с помощью отбора культуральной среды с организмами в прозрачные емкости различного объема. Прямой контроль за зоопланктонными организмами могут вести только специалисты: подсчитывается численность планктеров в специальных камерах в 1 мл с пересчетом на 1 м3).
Контроль за развитием численности фитопланктона также можно проводить как прямым, так и косвенным методами. При прямом методе контроля учитывается количество организмов с пересчетом на 1 м3 и определяется соотношение живых и отмерших клеток. Учет фитопланктона прямым методом – очень трудоемкая работа, требующая от исполнителя высокой квалификации. Из косвенных методов наиболее простым является метод визуального контроля. С помощью диска Секки (круглая металлическая пластина, окрашенная в белый цвет, крепится на размеченный трос) измеряют прозрачность и определяют цвет столба воды над его белой поверхностью. С увеличением развития фитопланктона прозрачность уменьшается, и вода над диском становится зеленоватого цвета. С «падением» биомассы фитопланктона прозрачность увеличивается, а цвет воды приобретает буроватый оттенок. Если прозрачность по диску Секки составляет 10-15 см, то от внесения питательных смесей следует воздержаться. При прозрачности воды более 50 см рекомендуется вносить смеси.
Таблица 7 Нормы и периодичность внесения ингредиентов (на 1 м3) для культивирования инфузорий и коловраток
Примечание 1: по достижении температуры культуральной среды выше 20 °С нормативы внесения ингредиентов рекомендуется уменьшать в 2 раза. Примечание 2: по достижении численности коловраток более 10 млн. экз./л, а инфузорий более 100 млн. экз./л нормативы внесения ингредиентов рекомендуется увеличивать в 2 раза. Примечание 3: питательная смесь вносится за 10-20 суток до внесения маточной культуры.
ВЫВОДЫ
Предлагаемый метод массового выращивания зоопланктона получен в результате создания единой трофической цепи: питательные смеси – фитопланктон-микрозоопланктон или мезозоопланктон. По обобщенным результатам исследований приводятся виды зоопланктона, рекомендуемые для выращивания на питательных смесях, а также основные параметры их содержания (табл. 4, 5).
Использование определенных питательных смесей в качестве корма для зоопланктона приводит к сокращению самого дорогостоящего трофического звена – культивирования микроводорослей, применяемых для кормления зоопланктона. Питательные смеси служат удобрениями, способствующими развитию простейших и фитопланктона, одновременно получается зоопланктон, обогащенный витаминами, микроэлементами и незаменимыми аминокислотами (табл. 6, 7).
Для улучшения гидрохимического режима и дополнительного бактериального питания на дно выростных емкостей и прудов рекомендуется вносить коралловые или ракушечные фракции в качестве подстилающего слоя (размерный состав фракций не менее 1 см и не более 5 см) либо каменистые пористые структуры в количестве 3-8 кг/м2. После непродолжительного контакта этих структур с морской водой (2-5 сут.), обогащенной вносимыми питательными смесями, на поверхности структур образуется бактериальный слой (мелкодисперсные обрастания), в водной среде начинается дополнительное развитие фитопланктона и протистов. Помимо этого, структуры служат как поглощающий фильтр для разлагающейся органики.
Общая биотехнологическая схема промышленного получения зоопланктона: 1. приготовление питательных смесей на основе удобрений и различных химических и биоактивных ингредиентов; питательные смеси рекомендуется готовить в емкостях объемом не более 4 м3; 2. выделение культур зоопланктеров из природных водоемов; внесение питательных смесей в
подготовленные емкости для содержания маточной культуры, объем не более 500 л; 3. через 10-20 суток после первого добавления смесей внесение организмов в емкости для выра-
щивания маточной культуры и собственно ее выращивание; 3. подготовка емкостей для массового выращивания зоопланктона; внесение питательных сме-
сей в емкости для культивирования; отбор гидробионтов для массового выращивания; 4. через 15-30 суток после первого внесения смесей вводится маточная культура планктеров для промышленного выращивания зоопланктона; массовое культивирование и сбор продукции гидробионтов.
Н. В. Новосёлова, ст. н. с., В. Н. Туркулова, зав. лаб.
Керченский филиал («ЮгНИРО») ФГБНУ «АзНИИРХ» e-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.