Паразитологическое исследование
Для паразитологического исследования используют живых или только что уснувших рыб всех возрастных категорий. Берут следующее количество рыб: мальков - 25 экз., сеголетков-15-25 экз., годовиков-10-15 экз., остальных возрастных групп по 3-5 экз.
Исследование проводят в следующем порядке: кожа, плавники, ротовая полость, жабры, глаза, кровь, сердце, брюшная полость (печень, селезенка, плавательный пузырь, мочевой пузырь, желчный пузырь, почки, половые железы, кишечник), мышцы, головной и спинной мозг.
Результаты исследований вносят в рабочий журнал, где указывают дату, место вылова рыбы, пол, возраст, массу и длину рыбы, данные паразитологического исследования с предварительным и окончательным определением паразитов.
Для обнаружения трипанозом и криптобий у рыбы берут кровь из сердца и делают мазки.
Для предотвращения свертывания крови добавляют 1 %-ный раствор лимоннокислого натрия, накрывают покровным стеклом и микроскопируют. Чтобы мазок не высыхал, края покровного стекла смазывают вазелином. Одновременно несколько мазков крови высушивают на воздухе, фиксируют в метиловом спирте, окрашивают по Романовскому - Гимзе или гематоксилином и микроскопируют.
Кожный покров. При наружном осмотре кожного покрова и плавников собирают всех паразитов, видимых простым глазом: паразитических ракообразных, пиявок, нематод и других (их предварительно определяют и фиксируют для последующего изучения). Затем скальпелем снимают слизь со всей поверхности тела (мальки, сеголетки, годовики) или с нескольких участков (крупные рыбы) и с плавников, микроскопируют, помещают ее на предметное стекло и смешивают с 2-3 каплями прокипяченной и остуженной воды. Накрывают покровным стеклом и просматривают сначала под лупой, а затем под малым увеличением микроскопа. Возбудителя костиоза можно обнаружить только при среднем увеличении микроскопа. Кроме возбудителей костиоза, на коже рыб паразитируют другие жгутиконосцы, инфузории, моногенетические сосальщики и др. Обнаруживают также споровиков, локализирующихся в дермальных бугорках. Под кожей, в подчешуйных кармашках и в лучах хвостового и спинного плавников иногда находят нематод.
Крупных паразитов (рачков, гельминтов) подсчитывают в абсолютных числах, а мелких (споровиков, инфузорий и других простейших) - в относительных, то есть учитывают число паразитов в десяти полях зрения микроскопа и определяют средние показатели. При этом высчитывают экстенсивность и интенсивность заражения каждым паразитом в отдельности для рыб каждого вида и возраста.
При осмотре кожного покрова можно видеть пигментированные пятна (черного цвета). В этих местах в толще кожи локализуются метацеркарии Posthodiplostomum cuticula. На плавниках встречаются цисты сосальщика Bucephalus.
После кожного покрова обследуют жаберный аппарат. Жаберные дужки помещают на предметное стекло, всех паразитов, видимых простым глазом, подсчитывают и фиксируют. С жаберных лепестков делают соскоб или берут жаберные дужки и с несколькими каплями воды зажимают между двумя предметными стеклами до прозрачности и исследуют под малым увеличением микроскопа.
Споровики, некоторые инфузории и личинки сосальщиков могут быть и в соединительных образованиях (бугорках); обнаружить и извлечь их можно только после разрыва стенки бугорка с помощью препаровальной иглы. В кровеносных сосудах жабр встречаются яйца сангвиникол, споры и мицелий гриба.
Глаза. Для обнаружения паразитов (личинок сосальщиков) глаза извлекают из глазных впадин, кладут на предметное стекло и вскрывают острыми ножницами с внутренней стороны. Стекловидное тело, хрусталик и содержимое передней камеры глаза помещают между двумя предметными стеклами и просматривают под малым увеличением микроскопа.
Брюшная полость. Вскрывают брюшную полость по методике, описанной в разделе "Бактериологическое исследование", с той только разницей, что при паразитологическом исследовании нет необходимости соблюдать условия стерильности. Дугообразный разрез к основанию левого грудного плавника ведут от анального отверстия, вводят непосредственно в него тупой конец одной из бранш ножниц. Вскрытую брюшную полость осматривают, крупных паразитов (лигуна и др.) извлекают, а имеющиеся на серозных покровах и брыжейке бугорки микроскопируют.
Сердце вынимают вместе с крупными сосудами, помещают бактериологическую чашку с физилогическим раствором, вскрывают его полости, промывают образовавшийся осадок и микроскопируют на наличие возбудителя сангвиниколеза и некоторых метацеркариев.
Печень. При наружном осмотре печени можно обнаружить на ее поверхности личинок круглых червей и белые бугорки с заключенными в них личинками ленточных червей. Чтобы обнаружить паразитов, обитающих внутри печени, ее делят на небольшие кусочки, компрессируют и исследуют под лупой, а затем под малым увеличением микроскопа. Желчный пузырь вырезают, помещают на предметное стекло, разрезают ножницами, делают соскоб с внутренней оболочки стенки пузыря. Соскоб и сам желчный пузырь помещают между двумя предметными стеклами и исследуют под лупой или микроскоп. В желчном пузыре можно обнаружить простейших сосальщиков и личинок ленточных червей.
Селезенку исследуют так же, как печень.
Почки. Для обнаружения паразитов кусочки органа помещают между стеклами и исследуют под микроскопом. В почках можно найти крупных паразитов, споровики, яйца сосальщиков, занесенных током крови.
Плавательный пузырь. Наружную волокнистую оболочку плавательного пузыря снимают. Паразиты, находящиеся в его стенке и полостях. Обычно хорошо видны. Их извлекают и исследуют. Иногда берут соскоб с внутренней оболочки пузыря больной рыбы и тщательно микроскопируют.
Мочевой пузырь. Методика исследования сходна с исследованием желчного пузыря. В мочевом пузыре обнаруживают сосальщиков, споровиков и инфузорий.
Половые железы. Для обнаружения паразитов железу частями компрессируют между двумя стеклами и просматривают под микроскопом. В половых железах встречаются микроспородии и крупные плероцеркоиды, окруженные фиброматозными сумками.
Желудочно - кишечный тракт. Пищевод, желудок и кишечник извлекают, освобождают от жира, расправляют и вскрывают, начиная с пищевода. Обнаруженных крупных паразитов (ленточных и круглых червей, сосальщиков) помещают в физиологический раствор. Содержимое из разных отделов желудочно - кишечного тракта исследуют компрессорным методом под микроскопом. Затем с помощью скальпеля делают глубокий соскоб со слизистой оболочки из нескольких мест и исследуют на наличие микроскопических паразитов.
Мысшцы. Для обнаружения зараженности рыб плероцеркоидами, лентецами и другими крупными паразитами мысшцы разрезают на пластинки толщиной 5 мм и просматривают. Чтобы найти мелких паразитов, берут небольшие кусочки мышц из различных частей тела и исследуют компрессорным методом под лупой и под малым увеличением микроскопа.
Головной и спинной мозг исследуют компрессорным методом. В этих органах можно обнаружить споровиков Myxosoma cerebralis Tetrocotyle variegateu.
Хрящи. Для обнаружения возбуителя миксозомоза (вертежа лососевых) компрессорным методом исследуют черепные и межпозвоночные хрящи.
Мазки крови окрашивают азур-эозином по Романовскому - Гимзе. Готовую краску Романовского перед окрашиванием разводят нейтральной дистиллированной водой из расчета 2 - 3 капли краски на 1 мл воды.
Растворметиленовой сини перед употреблением разводят дистиллированной водой 1:10 и окрашивают мазки 30 с, затем промывают водой и дифференцируют в течении нескольких секунд 5 - 10%-ным раствором танина. Эритроциты окрашивают в красновато-фиолетовый цвет, плазма простейших кровепаразитов - в ярко-голубой, ядра лейкоцитов - в фиолетовый.
Для изучения морфологии паразитических инфузорий их окрашивают железным гематоксилином по Гейденгайну, а также гематоксицилином Делафильда или квасцовыми кармином.
Паразитических жгутинконосцев окрашивают железным гематоксилином или по Романовскому - Гимзе.
Слизистых споров окрашивают 1%-ным водным раствором метиленового синего 30 - 60 мин, затем препарат промывают в воде, последовательно проводят через спирты возрастающей крепости (70, 80, 96%-ный и абсолютный) и просветляют ксилолом.
Трематод и цестод окрашивают квасцовым кармином. Фиксированные в спирте препараты промывают в течении нескольких часов в проточной или часто сменяемой воде и помещают в краску от одной минуты до нескольких часов (в зависимости от толщины гельминта). Продолжительность окраски можно контролировать микроскопией препаратов. Окрашенные препараты переносят в дистиллированную воду, где в течении нескольких минут их тщательно отмывают от краски. Отмытых паразитов осторожно сушат фильтрованной бумагой и проводят через спирты возврастающей крепости (70, 80, 96%-ным), выдерживая в них несколько часов. Обезвоженных паразитов просветляют маслом и ксилолом.
Мелких цестод мождно окрашивать молочнокислым кармином по Блажину. Молочную кислоту разводят в 2 раза дистиллированной водой, добавляют небольшое количество кармина (в зависимости от желаемой степени окраски). Жидкость кипятят. Красить лучше свежие, нефиксированные объекты. Продолжительность окраски контролируют под микроскопом, а в случае перекрашивания объект переносят в цельную молочную кислоту для обесцвечивания. Окрашенный препарат промывают 20-60 мин водопроводной водой и помещают в бальзам.
При окраске крупных цестод этот способ модифицировали. Цестод промывают в проточной или часто сменяемой водопроводной воде при комнатной температуре летом один день, в холодное время года - 3-4 дня. Затем их помещают на 4-6 ч в краску (0,3 г кармина на 100 мл 30 %-ной молочной кислоты). Интенсивность прокрашивания контролируют под микроскопом. После этого на сутки их переносят в дистиллированную воду, в которую добавляют 3 капли раствора сернокислого железа и 2 капли 1%-ного раствора фенола. Далее цестод переносят на чистое предметное стекло, расправляют и высушивают при температуре 30-37°. Высохший очень плотно приставший к стеклу препарат заливают канадским бальзамом или канифолью, растворенной в смеси, состоящей из равных частей хлороформа и абсолютного спирта.
Для приготовления временных препаратов нематод не окрашивают, а кладут для просветления в неразведенную молочную кислоту или лактофенольный раствор (2 части глицерина, 1 часть молочной кислоты, 1 часть фенола и 1 часть воды) на 3-10 дней. Мелких гельминтов на 1-2 дня помещают в молочную кислоту (1-2 капли) и накрывают покровным стеклом.
Постоянные препараты для микроскопического исследования нематод готовят так. Фиксированных в 70 %-ном спирте живых гельминтов через сутки помещают на несколько часов (в зависимости от величины нематод) в 96 %-ный, а затем в абсолютный спирт на 3-5 мин. После этого их переносят в гвоздичное или хеноподиевое масло или карбоксилол на 2-5 мин, а затем кладут на чистое предметное стекло и заливают бальзамом.
Скребней (акантоцефалов) для изучения хоботка и крючков просветляют. Для этого их из 70 %-ного спирта переносят сначала в 50 %-ный глицерин, а затем в чистый. Структуру других органов изучают после полного обезвоживания гельминтов путем постепенного проведения их через спирты возрастающей крепости. Из абсолютного спирта гельминтов переносят на предметное стекло в каплю кедрового масла, покрывают покровным стеклом и микроскопируют.
Паразитических рачков исследуют в той же жидкости, в которой хранят. Красить их не обязательно. Иногда прибегают к окраске борным кармином, эозином, сафранином и др.
Идентификацию паразитов проводят по "Определителю паразитов пресноводных рыб СССР" (Изд-во АН СССР, 1984-1985 гг., т. 1-3).
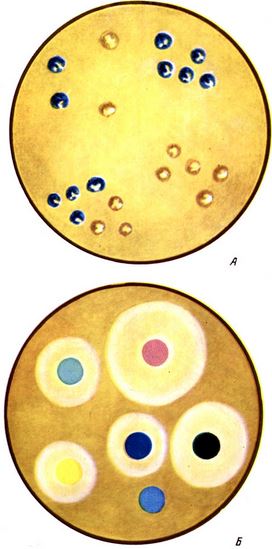
Таблица I. Колонии бактерий, положительно реагируют на цитохромоксидазу (окрашены в сине - голубой цвет) (А); Б - определение чувствительности бактерий к антибиотикам методом бумажных дисков на агаре
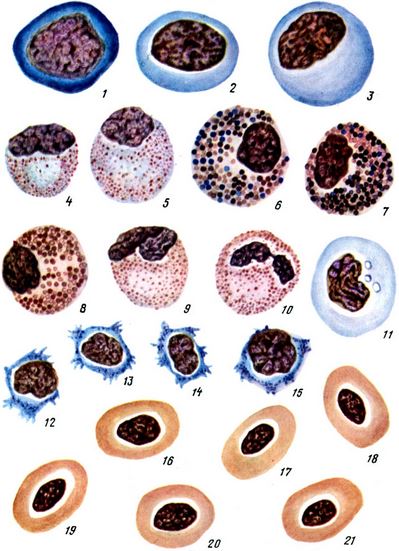
Таблица II. Кровь карпа в норме: 1 - гемоцитобласт; 2 - миелобласт; 3- промислоцит; 4 - нейтрофильный миелоцит: 5 - нейтрофильный, 6, 7 - базофильные и 8 - псевдозоэозинофильный метамиелоциты; 9, 10 - налочкоядерный и сегментноядерный нейтрофилы; 11 - моноцит; 12 - 15 - лимфоциты; 16 - 21 - эритроциты

Таблица III. Вирусная геморрагическая септицемия форели (по Гиттино): 1 - анемия и кровоизлияния в жабрах; 2 - геморрагии в мышцах и висцеральной жировой ткани; 3 - множественные геморрагии в мускулатуре, плавательном пузыре

Таблица IV. Аэромоноз (краснуха) карпов: 1,2- асцитная форма; 3 - язвенная форма
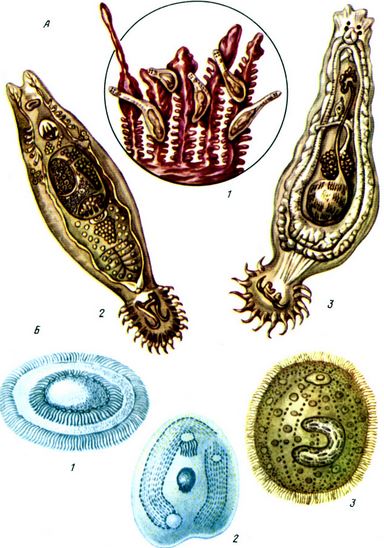
Таблица V. Гиродактилез и дактилогироз рыб (А): 1 - паразиты на жабрах; 2 - гидродактилюс; 3 - дактилогирус; Б - возбудители протозоиных болезней рыб: 1 - триходина; 2 - хилодонелла; 3 - ихтиофтириус

Таблица VI. Возбудители гельминтозов рыб: 1 - ботриоцефалюс: 2 - кавиа: 3 карп со зрелыми филометроидесами
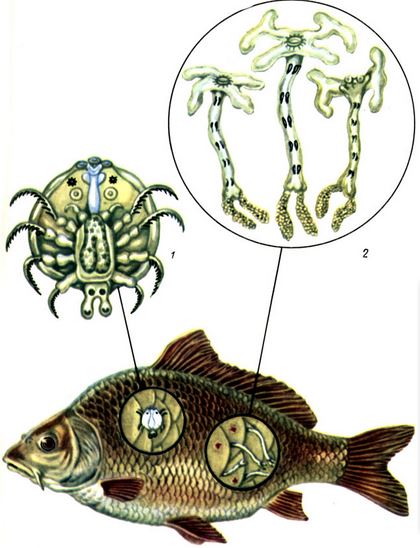
Таблица VII. Возбудители крустацеозов рыб: 1 - аргулюс: 2 - лернеа; 3 - пораженная рыба

Таблица VIII. Воспаление плавательного пузыря карпов (1); 2 - пузырь при остром и 3 - хроническом течении болезни